Estrutura de biftalato de potássio, nomenclatura, usos, riscos
- 2878
- 651
- Gilbert Franecki
Ele Biftalato de potássio É um composto químico, sólido, branco e solúvel, que está comercialmente em estado de alta pureza. É usado como um padrão primário para padronizar soluções em qualificações ácidas-base; Também é usado como uma solução buffer para manter o pH das soluções estáveis.
É um composto estável e não -higroscópico, que facilita a preparação da solução, pois não absorve a água durante o processo pesado. Pode ser preparado pela reação entre o ácido fotal e uma solução KOH, na qual um hidrogênio da molécula de ácido ftálico é substituído por um átomo de potássio.
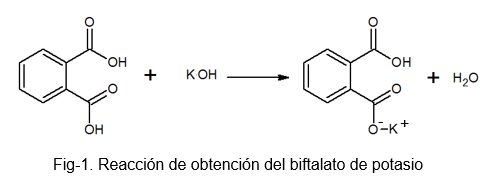
Biftalato de potássio recebe esse nome porque em sua molécula há um hidrogênio levemente ácido. Este hidrogênio é o encontrado no grupo -OH que está localizado ao lado do grupo carbonil, que faz parte do carboxil que não reage. Esse tipo de sais são conhecidos como sais ácidos, pois não são totalmente neutros.
[TOC]
Estrutura química

Fórmula
C6H4COOHCOOK = c8H5 Ko4
Nomenclatura
- Biftalato de potássio.
- Ftalato de ácido de potássio.
- Hidrogenoftaloftalo de potássio.
Propriedades
Densidade
1.636 g/ml.
Massa molar
204.22 g/mol.
Solubilidade
Água e álcool.
Ponto de fusão
295 ° C com decomposição.
Aspecto
Branco -to -white sólido.
Peso específico
1,64 gr/cm3.
Estudo derivado de biftalato de potássio
Medições de dericrográficas mostraram que a decomposição do biftalato de potássio começa entre 190 ° C e 200 ° C, e a preparação não -higroscópica pode ser preparada entre 100 ° C e 150 ° C.
A decomposição prossegue em três etapas, cuja velocidade depende da taxa no aumento da temperatura: o ftalato de dipbotássio é formado pela primeira vez, o anidrido phtalic e a água são eliminados.
Pode atendê -lo: cloreto de cálcio (CACL2)As alterações de entalpía também podem ser obtidas da derivada, isso produz informações sobre o mecanismo adicional de decomposição térmica e as alterações do estado da amostra.
Usos e aplicações
Este composto é usado na química analítica na titulação ou avaliação ácido-base como padrão primário para padronização na preparação de soluções de diferentes compostos.
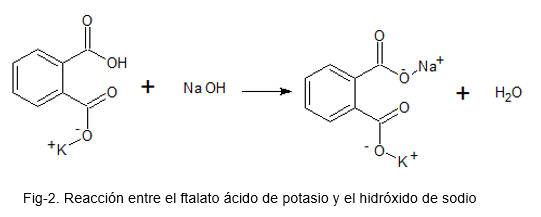
Padronização de uma base (Alkali = NaOH)
Ao preparar uma solução de NaOH, não é garantido que a concentração com a qual a solução permaneça esteja correta; Isso ocorre porque o NaOH é uma substância sólida muito higroscópica (absorva o ar do ar) e, para pesar, permanece com alguma umidade, o que torna a quantidade de substância não a mais ideal.
Uma vez que a solução é preparada, é necessário saber exatamente qual concentração ela permaneceu.
Para isso, uma solução é preparada com ftalato de ácido de potássio, que é um padrão primário (devido à sua alta estabilidade); São adicionadas algumas gotas de indicador de base ácido da fenolftaleína e a solução NaOH como um título é adicionada até que uma cor rosa seja mantida presente na solução de ftalato de ácido de potássio.
Com os dados obtidos, os cálculos pertinentes são feitos para encontrar a concentração real do NaOH.
A imagem a seguir ilustra a reação química entre ftalato ácido de potássio e hidróxido de sódio.

Como uma solução buffer na determinação do pH
Uma solução tampão ou tampão é a formada pelo sal ácido e ácido, isso faz com que ele permaneça em condições de modo que o valor do pH não mude quando pequenas quantidades de ácido ou base são adicionadas.
Pode servir a você: gravimetria: análise gravimétrica, métodos, usos e exemplosRiscos
- Exposição ao incêndio. Como na maioria dos sólidos orgânicos, é possível que o fogo a altas temperaturas ou por contato com uma fonte de ignição possa ocorrer.
- A poeira fina dispersa no ar em concentrações suficientes e, na presença de uma fonte de ignição, é um potencial de explosão de poeira perigosa.
- É uma substância estável à temperatura ambiente e em condições de armazenamento adequadas. O calor e a umidade excessivos devem ser evitados.
- Pode ser incompatível com oxidantes fortes, como o ácido nítrico.
- A decomposição pode formar óxidos de carbono que são tóxicos.
Em relação à saúde
- Por ingestão acidental, pode causar vômitos, diarréia e irritação nas membranas devido à sua acidez.
- Por inalação, causa irritação nas vias aéreas e tosse.
- Na pele, causa irritação.
- Aos olhos, causa irritação, vermelhidão e dor.
- Considera -se que não é uma substância carcinogênica, teratogênica ou mutagênica.
Emergência e primeiros socorros
- Lave os olhos com muita água, remova diminui o caso de carregá -los e deixar a água passar pelos olhos sem ser tocada com as mãos.
- Se houve contato com a pele, remova roupas e calçados, lave com muita água e lave as roupas muito bem antes de usar novamente.
- Em caso de ingestão, evite provocar vômito, água potável.
- Em caso de inalação, leve a pessoa para respirar ar fresco; Em caso de respiração difícil, forneça oxigênio.
- Em todos os casos, solicite assistência médica urgente.
- Em caso de vazamentos ou derramamentos, colete o produto em um recipiente limpo e tente fazer com que a poeira não se disperse.
Pode atendê -lo: quais são os efeitos negativos que temos com a solubilidade da água?Medidas de proteção pessoal
- Fique fora do local onde bebidas, comida e alimentação são armazenadas (comida de estimação).
- Use máscaras anti -poeira, neoprene ou luvas de PVC. Atualmente, luvas de nitrila são usadas.
- Use roupas adequadas que cobrem a maior parte do corpo, incluindo botas cobertas ou sapatos e copos de segurança.
- Recomenda -se a ventilação local de exaustão, com o sistema de extrator de ar, levando em consideração a direção predominante do vento.
- O produto é miscível na água, não é absorvido no solo, não é bioacumulável ou biodegradável, não é esperado que afete a vida aquática. No entanto, no momento de descartá -lo, isso deve ser feito com a ajuda de pessoal especializado: não descarte pelos drenos.
- Armazene em área laranja/verde, local fresco seco e ventilado e separado de material incompatível.
Referências
- Merck, (S.f), Merckmillipore.com
- Chang R.,(1992), Chemistry, (Quarta edição), México, McGraw-Hill Interamerican do México S.A, de C.V
- Reagentes de química meyer (s.f), folha de dados de segurança, biftalato de potássio, recuperado de reagentesMeyer.com.mx
- Belcher, r.,Erdey, l.,Paulik, f.,Liptay.G.,(Julho de 1960), fogo de hidrogenoftato de potássio, Cientedirect, Volume 5, edição 1, Páginas 53-57, org/10.1016/0039-9140 (60) 80205-6

