Estrutura de Berkelio (BK), propriedades, obtenção, uso

- 793
- 12
- Pete Wuckert
Ele Berkelium É um elemento químico cujo símbolo é bk. Pertence à classe de actinídeos, sendo seu oitavo membro. Seu número atômico é 97. É um sólido metálico sintético. Este elemento não é encontrado naturalmente sobre a crosta terrestre. Está presente em pequenas quantidades em combustíveis nucleares gastos e tem um brilho de prata.
Também existem pequenas quantidades dispersas no ambiente devido aos testes de armas nucleares, devido a acidentes graves em instalações de energia atômica, como Chernobyl e pela liberação que ocorre com resíduos de usinas de energia nuclear.
 Símbolo, número e massa atômica do elemento Berkelio. Fonte: ME/CC BY-S (https: // CreativeCommons.Org/licenças/BY-SA/2.5). Fonte: Wikimedia Commons.
Símbolo, número e massa atômica do elemento Berkelio. Fonte: ME/CC BY-S (https: // CreativeCommons.Org/licenças/BY-SA/2.5). Fonte: Wikimedia Commons. Uma utilidade prática para Berkelio não foi encontrada, porque ocorre em quantidades muito pequenas e no fato de que todos os seus isótopos (átomos de BK com número diferente de nêutrons no núcleo) são radioativos. Sua principal aplicação tem sido em estudos científicos.
Embora seus isótopos sejam produzidos artificialmente em laboratórios especiais e sejam tratados por pessoal especializado, os danos que a radiação perigosa emitida sempre deve ser levada em consideração.
[TOC]
Nomenclatura
- Berkelio, símbolo BK.
- Berkelio-243, BK-243 ou 243BK: Berkelio Isótopo com massa atômica 243.
Descoberta
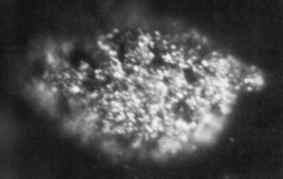 1.7 Microfotografia Microgramas de Berkelio metálico sólido obtido em 1969. Laboratório Nacional de Oak Ridge, Departamento de Energia dos EUA / Domínio Público. Fonte: Wikimedia Commons.
1.7 Microfotografia Microgramas de Berkelio metálico sólido obtido em 1969. Laboratório Nacional de Oak Ridge, Departamento de Energia dos EUA / Domínio Público. Fonte: Wikimedia Commons. Foi produzido pela primeira vez em 1949 pelos cientistas Glen Seaborg, Stanley G. Thompson e Al Ghiorso na Universidade de Berkeley, na Califórnia, quando bombardearam o Americio-241 com partículas alfa de alta energia usando um ciclotron (um acelerador de partículas).
Imediatamente após a irradiação, o material foi devidamente dissolvido e passado por uma coluna de resina de troca iônica, usando uma solução de citrato de amônio como eluente.
Dessa maneira, eles obtiveram um isótopo do elemento número 97 com 243 massa atômica, que emite partículas alfa e tem meia -vida de 4,5 horas.
Nome do elemento
No início, vários pesquisadores propuseram que o elemento tomasse o nome de um de seus descobridores, Glen Seaborg, já que ele tinha o mérito de ter conseguido sintetizar 10 elementos em vários anos de trabalho.
Pode atendê -lo: BeakerNo entanto, a Organização Oficial União Internacional de Química Pure e Aplicada ou IUPAC (sigla para inglês União Internacional de Química Pura e Aplicada) decidiu atribuir o nome "Berkelio" por ter sido obtido na Universidade e na cidade de Berkeley (Califórnia).
 Aparência de uma área da Universidade de Berkeley, Califórnia. Autor: Sarangib. Fonte: Pixabay.
Aparência de uma área da Universidade de Berkeley, Califórnia. Autor: Sarangib. Fonte: Pixabay. O nome Berkeley vem do filósofo dos Angloirlandés, George Barkeley, um nome cuja pronúncia mudou nos Estados Unidos quando a cidade e a universidade foram fundadas em 1869.
Casualmente foi o ano em que Dmitri Mendeléyev publicou sua primeira tabela periódica e começou a prever a existência de novos elementos como Berkelio.
Estrutura eletrônica
Sua configuração eletrônica é:
1s2; 2s2 2p6; 3s2 3p6 3d10; 4s2 4p6 4d10 4F14; 5s2 5p6 5d10; 6s2 6p6; 5F9 7s2,
ou compacto:
[RN] 5F9 7s2.
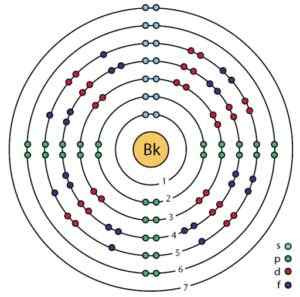 Estrutura eletrônica de Berkelio. Orbitais e elétrons podem ser vistos. Ahazard.ScienceWriter/CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/4.0). Fonte: Wikimedia Commons.
Estrutura eletrônica de Berkelio. Orbitais e elétrons podem ser vistos. Ahazard.ScienceWriter/CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/4.0). Fonte: Wikimedia Commons. Obtenção
A primeira amostra do metal foi preparada em 1969 através de uma reação de redução de fluoreto (BKF3) Com metal de lítio (LI) a uma temperatura de 1300 K.
Para preparar folhas finas de metal, o óxido de BKO é reduzido2 Com Torio (Th) ou Lantano Metallic.
Propriedades físicas de Berkelio
Estado físico
Sólido metálico solto.
O Berkelio Metal possui duas formas cristalinas: Alpha (Hexagon Double Compact) e Beta (cúbico centrado em faces).
Massa atômica
247
Ponto de fusão
1050 ºC (forma alfa)
986 ° C (formulário beta)
Ponto de ebulição
2627 ºC
Densidade
14,78 g/cm3 (forma alfa)
13,25 g/cm3 (Formulário beta)
Paramagnetismo
De acordo com algumas fontes, certos compostos de Berkelio mostram propriedades paramagnéticas, o que significa que eles são atraídos para campos magnéticos.
Essa característica é do tipo paramagnético porque, ao suspender a ação magnética, o material falha em manter essas propriedades sozinhas.
Propriedades quimicas
Em altas temperaturas, o Berkelio metálico é rapidamente oxidado no ar ou oxigênio, formando seus óxidos. É facilmente solúvel em ácidos minerais, liberando o gás hidrogênio H2 e formando íons BK3+.
Pode servir a você: hidreto de alumínio (ALH3): estrutura, propriedades, usosEstados de oxidação
As investigações iniciais desse elemento foram limitadas a experimentos de troca de íons e coprecipitação, com os quais se observou que o estado de oxidação +3 é estável e o +4 está acessível em solução aquosa, uma vez que o BK3+ Pode ser oxidado pelo íon bromato (mano4-) Para dar BK4+.
Estabilização de BK4+
Em 2017, a estabilização do BK foi relatada4+ em solução usando o composto formado por grupos de hidroxipiridinona unidos a uma estrutura de poliamina (chamada ligante 3,4,3-li (1,2-hop)).
Este composto tem oito lugares onde o íon se une, que correspondem aos átomos de oxigênio dos grupos C = O e N-OH, deixando o BK4+ firmemente ligado ao ligante, permanecendo estável.
Compostos sólidos
O bk4+ pode coprecipitar com cerio (CE4+) ou zircônio (ZR4+) em fosfato ou yodato. Também pode ser extraído em soluções bis hexano (2-etilhexil) hidrogenofosfato ou outro agente de acomodação semelhante.
O primeiro composto Berkelio que ocorreu em quantidades visíveis foi o cloreto (BKCL3), dos quais 0,000000003 gramas foram obtidos em 1962. Desde então, vários compostos de Berkelio foram capazes de se preparar e estudar.
Eles podem ser mencionados, por exemplo, fosfato (BKPO4), oxicloreto (BKOCL), Fluorides (BKF3 e bkf4), Dióxido (BKO2), Trioxide (BK2QUALQUER3), Yodatos (BK (io3)3 e bk (io3)4), Cloro -hidrato [BKCL2(H2QUALQUER)6] Cl, oxalato, compostos organometais e compostos de coordenação, entre outros.
Novo estado de oxidação +5
Em 20185+) cuja fórmula é BKO2(NÃO3)2-, eliminando duas moléculas sem moléculas2 do íon BK (não3)4-, (Bk3+).
Os cálculos de energia computacional confirmaram que o estado de oxidação +5 é o que tem a maior estabilidade neste complexo de nitrato de Berkenilo, portanto, o mais provável.
Isótopos
De Berkelio, 14 isótopos com massas atômicas foram sintetizadas de 238 a 251. Todos são radioativos.
Pode atendê -lo: Benchilo: hidrogênios benzil, carbocações, radicais benzilO mais estável é o Berkelio-247, cuja meia-vida é de 1380 anos. Cada átomo desse isótopo quando a desintegração emite uma partícula alfa e forma um átomo da América-243.
O BK-249 tem meia-vida de 330 dias, sofre decaimento beta e se torna californio-249.
Formulários
Como eles só foram capazes de obter quantidades muito pequenas desse elemento, ele só foi usado na pesquisa científica básica.
Na obtenção de elementos mais pesados
O isótopo BK-249 tem uma meia-vida relativamente longa e é possível.
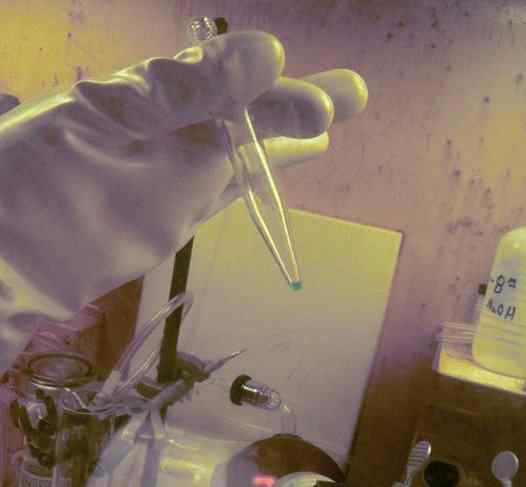 Microcantidade BK dissolvida em um tubo de ensaio. 250 dias foram usados para obtê -lo. A luva de proteção de radioatividade deste elemento pode ser observada. ORNL, Departamento de Energia / Domínio Público. Fonte: Wikimedia Commons.
Microcantidade BK dissolvida em um tubo de ensaio. 250 dias foram usados para obtê -lo. A luva de proteção de radioatividade deste elemento pode ser observada. ORNL, Departamento de Energia / Domínio Público. Fonte: Wikimedia Commons. Em estudos físico -químicos
A pesquisa realizada com o BK permite extrapolações mais precisas sobre as propriedades e o comportamento de outros elementos que se seguem na série de atuação, pois os elementos mais pesados são mais difíceis de obter, eles têm vidas médias muito curtas e são muito mais radioativas.
Riscos
Berkelio é um elemento radioativo. A liberação de radioatividade no ambiente pode alcançar todas as espécies de animais e plantas causando danos a eles. A deterioração pode se acumular em gerações sucessivas.
 As usinas de energia nuclear são radioativas e, portanto, muito perigosas. Autor: AR130405. Fonte: Pixabay.
As usinas de energia nuclear são radioativas e, portanto, muito perigosas. Autor: AR130405. Fonte: Pixabay. Referências
- OU.S. Biblioteca Nacional de Medicina. (2019). Berkelium - BK (elemento). Recuperado de PubChem.NCBI.Nlm.NIH.Gov.
- Branco, f.D. et al. (2019). Química Contemporânea do Berkelium e Californium. Química 2019 6 de agosto; 25 (44): 10251-10261. Recuperado do PubMed.NCBI.Nlm.NIH.Gov.
- Chumbo, d.R. (Editor) (2003). Manual de Química e Física do CRC. 85º CRC Press.
- Algodão, f. Albert e Wilkinson, Geoffrey. (1980). Química inorgânica avançada. Quarta edição. John Wiley & Sons.
- Kelley, m.P. et al. (2018). CoVOLECY e oxidação de títulos de actinídeo inseguro com o agente quelante terapêutico 3,4,3-LI (1,2-hopo). Inorg. Chem. 2018 7 de maio; 57 (9): 5352-5363. Recuperado do PubMed.NCBI.Nlm.NIH.Gov.
- Kovács, a. et al. (2018). Pentavalente Curio, Berkelium e Californium no Complexo de Nitrato: Estendendo Estados de Química e Oxidação de Actinídeos. Chem. 6 de agosto de 2018; 57 (15): 9453-9467. Recuperado do PubMed.NCBI.Nlm.NIH.Gov.
- Orlova, a.Yo. (2007). Química e química estrutural de ortofósforas de actinídeo tripravalente do triá. Na química estrutural de compostos inorgânicos de actinídeo. Recuperado de cientedirect.com.
- Choppin, g. et al. (2013). Os elementos de actinídeo e transactinídeo. Em radioquímica e química nuclear (quarta edição). Recuperado de cientedirect.com.
- Peterson, j.R. e Hobart, D.E. (1984). A química do berkelium. Avanços Inorgânicos Química, volume 28, 1984, páginas 29-72. Recuperado de cientedirect.com.
- Sociedade Real de Química. (2020). Berkelium. RSC se recuperou.org.
- « História da música da pré -história
- Características de planejamento didático, elementos, tipos, exemplo »

