História do Berílio, Estrutura, Propriedades, Usos

- 1451
- 256
- Conrad Schmidt
Ele berílio É um elemento metálico que pertence ao Grupo 2 ou IIA da tabela periódica. É o metal alcalino mais leve do grupo e é representado pelo símbolo be. Seu átomo e cátion também são menores que os de seus colegas (MG, CA, Sr.
Devido à sua densidade de carga incomum, esse metal geralmente não ocorre isoladamente. Eles conhecem cerca de 30 minerais que o contêm, entre os quais estão: o beryl (3beo · al2QUALQUER3· 62· 2h2O), o Bertrandita (4beo.2SE2.2h2O), El Chrisoberilo (Beal2QUALQUER4) e a Fenaquita (seja2Sim4).
 Beryll Pipitas metálicas. Fonte: w. Oelen [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)]
Beryll Pipitas metálicas. Fonte: w. Oelen [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)] La Esmeralda, uma pedra preciosa, é uma variante do Beryl. No entanto, o berílio puro não é tão impressionante; Parece brilho acinzentado pálido (imagem superior) e foi alcançada na forma de pepitas ou dragees.
O berílio tem um conjunto de propriedades físicas características. Tem uma baixa densidade; alto comportamento térmico e elétrico, bem como sua capacidade térmica e dissipação de calor; Não é um metal magnético; e também tem uma combinação apropriada de rigidez e elasticidade.
Todas essas propriedades levaram a Beryllium a ser um metal com muitas aplicações, desde o seu uso em ligas de cobre para a elaboração de ferramentas, até seu uso em foguetes, aviões, carros, reatores nucleares, equipamentos de raio -x, magnéticos nucleares de ressonância, etc. .
O berílio tem 10 isótopos conhecidos, variando de 5Ser um 14Ser, sendo o 9Seja o único estável. É também um metal muito tóxico, que afeta especialmente o sistema respiratório, então há uma limitação em seu uso.
[TOC]
História da sua descoberta
O berílio foi descoberto por Louis-Nicolas Vauguelin em 1798 como um elemento composicional do mineral de Berilo e um alumínio e silicato de Beryllium.
Posteriormente, o químico alemão Frederic Wöhler, em 1828, conseguiu isolar o berílio reagindo o potássio com cloreto de berílio em um pote de platina.
Simultaneamente e independentemente, o químico francês Antoine Bussy também alcançou o isolamento de Beryllium. Wöhler foi o primeiro a sugerir o nome de Beryllium para metal.
Ele recebeu seu nome atual no ano de 1957, já que era conhecido como Glucinium, devido ao sabor doce de alguns sais. Mas, para evitar confusão com outros compostos de sabor doce, e com uma planta chamada glucina, foi decidido mudar o nome de Beryllium.
Estrutura de berily
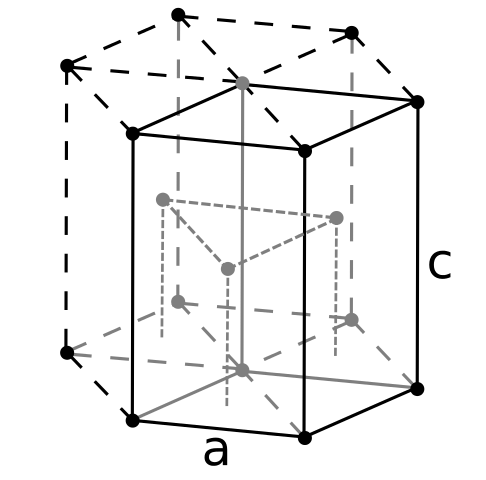 Estrutura Berily Crign. Fonte: Usuário: Dornfl [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)]
Estrutura Berily Crign. Fonte: Usuário: Dornfl [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)] Sendo Beryl o mais leve dos metais alcalinoterrosos, deve -se esperar que o volume de seus átomos seja o menor de todos. Os átomos de berylil interagem entre si através da ligação metálica, de modo que seu "mar de elétrons" e repulsões entre o modelo de núcleos a estrutura de vidro resultante resultante.
Pode atendê -lo: ácido periádico (HIO4): o que é, estrutura, propriedades, usaOs cristais negros do berílio são então formados. Esses cristais têm uma estrutura hexagonal (imagem superior), onde cada um tem seis vizinhos lados e outros três nos aviões superior e abaixo.
Sendo cristais negros, é útil. Esta é uma das estruturas mais compactas que um metal pode adotar; E faz sentido que os átomos tão pequenos de ser "espremer" ambos para evitar a menor quantidade de vazio ou número de orifícios entre eles.
Configuração eletronica
1s22s2
O que é igual a 4 elétrons, dos quais 2 são de Valência. Se um elétron para o orbital 2p for promovido, dois orbitais SP hbítrides terão. Assim, em compostos de berílio, pode haver geometrias lineares, x-be-x; Por exemplo, a molécula isolada de Becl2, Cl-BE-Cl.
Propriedades
Descrição física
Cor cinza sólida, brilhante e quebradiça.
Ponto de fusão
1287 ºC.
Ponto de ebulição
2471 ºC.
Densidade
- 1.848 g/cm3 à temperatura ambiente.
- 1,69 g/cm3 para o ponto de fusão (estado líquido).
Rádio atômico
112 pm.
Rádio covalente
90 pm.
Volume atômico
5 cm3/mol.
Calor específico
1.824 J/G · mol a 20 ºC.
Calor de fusão
12,21 KJ/mol.
Calor de evaporação
309 KJ/mol.
Eletro-negatividade
1.57 na escala Pauling.
Potencial padrão
1,70 v.
Velocidade do som
12.890 m/s.
Expansão térmica
11,3 µm/m · k a 25 ° C.
Condutividade térmica
200 w/m · k.
Propriedades quimicas
O berílio é coberto com uma camada de óxido beril (BEEO) que serve como proteção aérea à temperatura ambiente. A oxidação do berílio ocorre em temperaturas maiores que 1000 ºC, originadas como óxido de berílio e produtos de nitreto de berílio.
Também é resistente à ação do ácido nítrico 15 m. Mas, ele se dissolve em ácido clorídrico e álcalis, como hidróxido de sódio.
Formulários
Preparação de ferramentas
O berílio forma ligas com cobre, níquel e alumino. Em particular, a liga com cobre produz ferramentas de grande dureza e resistência, constituindo apenas 2% do peso da liga.
Essas ferramentas não produzem faíscas ao atingir o ferro, o que os permite para uso em ambientes com um alto teor de gases combustíveis.
Pode servir a você: térmico: estrutura, características, formação, exemplosDevido à sua baixa densidade, ele tem um peso leve, que, juntamente com sua rigidez, permite seu uso em aeronaves espaciais, foguetes, mísseis e aviões. A liga com berílio foi usada na elaboração de partes do carro. Também tem sido usado na elaboração de Springs.
Devido à grande dureza conferida por Beryllium a suas ligas, eles foram usados nos freios de aeronaves militares.
Espelhos Elaboração
O berílio tem sido usado na produção de espelhos devido à sua estabilidade dimensional e à sua capacidade de ter um alto portador. Esses espelhos são usados em satélites e sistemas de controle de incêndio. Além disso, os telescópios espaciais são usados.
Na radiação ionizante
O berílio é um elemento de baixa densidade, por isso pode ser considerado transparente para raios X. Esse recurso permite seu uso na construção das janelas dos tubos que produzem raios X, aplicação industrial e diagnóstico médico.
Da mesma forma, o berílio é usado nas janelas de detectores de emissões radioativas.
Nas equipes geradoras de magnetismo
Entre as características do berílio, não está sendo um elemento magnético. Isso permite que ele seja usado na construção de artigos de equipamentos de ressonância magnética, nos quais são gerados campos magnéticos de grande intensidade, minimizando qualquer interferência.
Reatores nucleares
Devido ao seu alto ponto de fusão, encontrou aplicação em reatores nucleares e cerâmica. O berílio é usado como moderador de reações nucleares e como produtor de nêutrons:
9Ser + 4Ele (α) => 12C +N (Nutron)
Estima -se que para um milhão de átomos de beryl que são bombardeados com partículas α, até 30 milhões de nêutrons ocorrem. Precisamente essa reação nuclear permitiu a descoberta do nêutron.
James Chadwick bombardeou átomos de berílio com partículas α (He). O pesquisador observou a liberação de partículas subácômicas, sem carga elétrica, o que levou à descoberta de nêutrons.
Protetor de metal
Adicione uma quantidade de berílio na superfície dos metais que podem ser oxidados, confere uma certa proteção. Por exemplo, a inflamabilidade do magnésio é reduzida e o brilho das ligas de prata é prolongado.
Onde está?
O beryl é encontrado no pegmatita, associado a mica, feldspato e quartzo. Com o uso de uma técnica de flutuação, é possível separar uma mistura de beryl e feldspato. Posteriormente, feldspato e beryl estão concentrados e sujeitos a um tratamento com hipoclorito de cálcio.
Pode atendê -lo: diferenças entre compostos orgânicos e inorgânicosSeguido por um tratamento com ácido sulfúrico e sulfonato de potássio, por diluição, a flotação beril é alcançada, separando -a do feldspato.
O beril é tratado com fluorossilicato de sódio e refrigerante a 770 ºC para formar fluorilato de sódio, óxido de alumínio e dióxido de silício. Em seguida, o hidróxido de berílio da solução de hidróxido de hidróxido de sódio é precipitado.
O fluoreto de berílio é formado reagindo o hidróxido de beryl com fluoreto de hidrogênio amoniacal, produzindo amônio amônio. Isso é aquecido para formar fluoreto de berílio, que é tratado com magnésio quente para isolar o berílio.
Riscos
O berílio como metal finamente dividido, na forma de soluções, poeira seca ou fumaça, é muito tóxica e pode produzir dermatite. No entanto, a maior toxicidade é produzida pela inalação.
Inicialmente, o berílio pode induzir hipersensibilidade ou alergia, que pode se tornar beliose ou doença crônica do berílio (CBD). Esta é uma doença grave, caracterizada por uma diminuição na capacidade pulmonar.
Doença aguda é rara. Na doença crônica, há formação de faruloma em todo o corpo, especialmente nos pulmões. A beliose crônica causa dispnéia progressiva, tosse e fraqueza geral (astenia).
A beliose aguda pode ser mortal. Na beliose, ocorre a perda progressiva da função respiratória, uma vez que há obstrução no fluxo das vias aéreas no trato respiratório e diminuição da oxigenação da pressão sanguínea.
Referências
- Sociedade Real de Química. (2019). Berílio. Recuperado de: RSC.org
- Centro Nacional de Informações sobre Biotecnologia. (2019). Berílio. Banco de dados PubChem. Recuperado de: pubchem.NCBI.Nlm.NIH.Gov
- Helmestine, Anne Marie, Ph.D. (15 de março de 2019). Fatos de berílio. Recuperado de: pensamento.com
- Wikipedia. (2019). Berílio. Recuperado de: em.Wikipedia.org
- Lentech b. V. (2019). Beryllium-Be. Recuperado de: lentech.com
- Material da corporação. (2019). Aprenda sobre o elemento berílio recuperado de: Beryllium.com
- D. Michaud. (12 de abril de 2016). Problema de processamento e extração de berílio. 911 Metalurgista. Recuperado de: 911Metallurgist.com
- Timothy p. Hanusa. (5 de janeiro de 2016). Berílio. Encyclopædia britannica. Recuperado de: Britannica.com
- Leia s. Novo homem. (2014). Doença de Berílio. Manual MSD. Recuperado de: msdManuals.com
- « História, objetivos e perfis da psicologia do esporte
- Globalização social Dimensão, vantagens e exemplos »

