Recursos de suporte, funções e exemplos
- 1734
- 14
- Lonnie MacGyver
As apoia São as formas inativas de enzimas, ou seja, são as enzimas que não possuem seus cofatores ou coenzimas, essenciais para realizar as reações catalíticas das quais estão no comando.
Enzimas são proteínas com atividade catalítica. Sua função está basicamente acelerando o curso de diferentes tipos de reações químicas nas células, um fato que é muito importante para a existência de todos os seres vivos da terra.
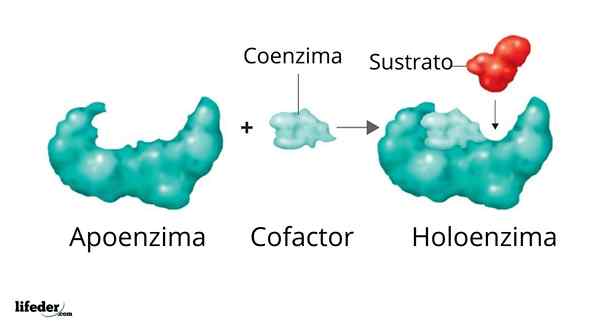
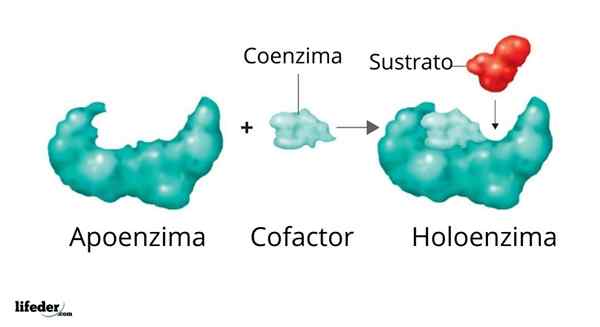 Uma holoenzima é formada por um apoiador e seu cofator/coenzima/grupo protético
Uma holoenzima é formada por um apoiador e seu cofator/coenzima/grupo protético A atividade de muitas enzimas depende da identidade e ordenação dos aminoácidos que os compõem, isto é, de suas próprias estruturas de proteínas e da integridade dessas estruturas em condições nativo.
Embora isso seja verdade para muitas enzimas, existem alguns que exigem elementos adicionais não -proteínas para executar suas funções. Tais elementos são conhecidos como Cofatores, Se estes são íons inorgânicos, ou coenzimas, Se estas são moléculas complexas ou orgânicas.
Geralmente, cofatores e coenzimas estão associados à relativa estabilidade à estrutura proteica das enzimas cuja atividade catalítica promove; Quando essa associação é permanente (covalente), esses grupos são então conhecidos como Grupos protéticos.
Exemplos de apoio
 Ilustração 3D da polimerase de DNA
Ilustração 3D da polimerase de DNA O conjunto enzimático ativo formado por uma proteína com atividade catalítica e seu grupo coenzima/coenzima/protético é chamado Holoenzima qualquer enzima conjugada. Em uma holoenzima, a porção de proteína corresponde ao que é conhecido como Apoio ou apoproteínas, que carece de atividade.
Exemplos de alguns apoios importantes são:
- A enzima Polimerase de DNA, Responsável por replicar o DNA celular, sem o íon divalente de magnésio que serve como cofator.
- A enzima Anidrase carbônica, responsável por catalisar a conversão de co₂ e h₂0 em íons bicarbonato e h+, sem o íon de zinco divalente que serve como cofator.
- A enzima hemoglobina, responsável pelo transporte de oxigênio dentro dos glóbulos vermelhos (eritrócitos) pelo sangue de animais de mamíferos, sem seu grupo protético Hemo.
- A enzima lactato desidrogenase, responsável pela produção de lactato a partir de piruvato, sem o NADH que serve como cofator.
Características das apoenzimas
O apoio são enzimas inativas que eles precisam, a fim de alcançar sua ativação, a união de um cofator ou uma coenzima, mas que não estão unidos a um a um.
Levando isso em consideração, pode -se dizer que essas moléculas compartilham certas características, a saber:
Eles são proteínas
Ao contrário dos co -fatores e coenzimas, que são elementos não proteicos necessários para as funções de holoenzimas, o suporte são proteínas.
A declaração anterior é entendida, então, de que os suportes são formados por cadeias de moléculas especiais conhecidas como aminoácidos, que estão ligadas através de um tipo de link conhecido como ligação peptídica.
A sequência de aminoácidos de cada suporte é geneticamente determinada e isso, por sua vez, condiciona sua ordem espacial ou tridimensional, intimamente relacionada à especificidade dos substratos, a união aos cofatores/coenzimas/grupos protéticos, estabelecimento do local ativo, etc.
Como proteínas, as apoenzimas também possuem: uma carga elétrica, determinada pelo seu teor de aminoácidos e pelo pH do meio onde são encontrados; Os requisitos de temperatura, pH e força iônica, característicos, na qual pode, na presença de cofatores, funcionar em sua velocidade ideal; inibidores e concorrentes, etc.
Eles podem se juntar a substratos
Embora não sejam capazes, por si só, de catalisar uma reação enzimática, muitos suportes mantêm a capacidade de se juntar aos substratos que participam da reação que os caracteriza; Por esse motivo, eles geralmente são usados em alguns contextos experimentais.
Eles podem se juntar a cofatores, coenzimas ou grupos protéticos
Na maioria dos casos, os suportes podem ser considerados como enzimas inativas que são preparado Para se juntar às moléculas que participam de suas funções, ou seja: para seus cofatores, coenzimas ou grupos protéticos.
Pode atendê -lo: flora e fauna da costa equatorianaOs cofatores podem participar diretamente de reações catalíticas ou simplesmente contribuir para a estabilização da estrutura geral da holoenzima.
Entre os principais cofatores que participam de holoenzimas celulares estão:
- Ferro (Fe2+)
- Cobre (Cu2+)
- Cálcio (Ca2+)
- Zinco (Zn2+)
- Magnésio (MG2)
- Manganês (Mn2+)
- Cobalto (CO)
- Níquel (NI)
Entre as principais coenzimas podem ser nomeadas:
- Vitaminas: B9, B3, C
- Adenosín Trifosfato (ATP)
- Flavín Adenín Dinucleotide (FAD)
- Nicotinamida ou nicotín dinucleotídeo dycleotide (NAD)
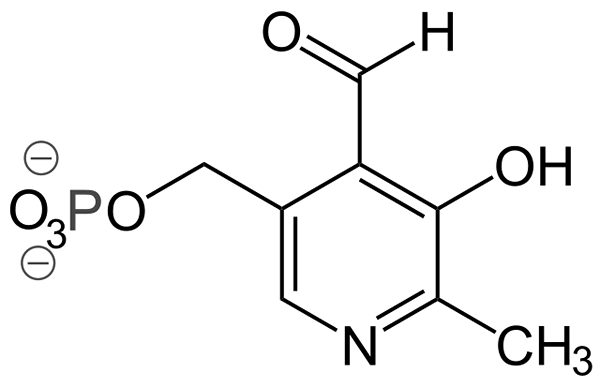 Estrutura piridoxal-fosfato (Fonte: Ayacop, Domínio Público, via Wikimedia Commons)
Estrutura piridoxal-fosfato (Fonte: Ayacop, Domínio Público, via Wikimedia Commons) Alguns grupos protéticos importantes são:
- Grupo Hemo
- Biotina
- Pirofosfato de tiamina
- Fosfato piridoxal
Funções dos subenzimas
Como os suportes são as porções proteicas das holoenzimas, é justo considerá -las como parte mais importante. Mesmo na presença das coenzimas, coenzimas e substratos apropriados, sem os suportes, nenhuma das reações enzimáticas catalisadas por essas enzimas poderiam ser realizadas.
Nesse sentido, a principal função de um suporte é contribuir com a principal estrutura da holoenzima à qual pertence, como o local da união para o cofator, a coenzima e/ou grupo protético e os substratos que participam da reação.
Do ponto de vista estrutural, uma holoenzima sem sua apoenzima nada mais é do que um cofator, e um cofator por si só nada mais é do que uma molécula relativamente inerte (biologicamente falando), de modo que o apoio está no comando, na realidade, para realizar A reação catalítica, assistida pelos elementos não -proteínas mencionados.
Pode atendê -lo: actinomycetesAssim, as funções do suporte, embora sejam enzimas inativas, dependem de:
- Sua cadeia linear de aminoácidos ou estrutura primária (se forem complexos enzimáticos formados por mais de uma subunidade, então seria discutido sobre "suas cadeias lineares").
- A maneira pela qual essas cadeias são ordenadas no espaço, ou seja, estruturas secundárias, terciárias e quaternárias, quando o caso.
- A conformação adequada dos locais que são fundamentais para a catálise, ou seja, o local catalítico com os aminoácidos que participam da reação, o local da união para as co -enzimas, coenzimas ou grupos protéticos; etc.
- A estabilidade da estrutura nas condições celulares ou nativo, fato que está diretamente relacionado à capacidade da apoenzima de formar holoenzima e outros.
Referências
- Boyer, p. D., & Krebs, e. G. (1986). As enzimas. Academic Press.
- Garrett, r. H., & Grisham, C. M. (2001). Princípios de bioquímica: com um foco humano. Brooks/Cole Publishing Company.
- Gruber, k., Puffer, b., & Kräutler, B. (2011). Vitamina B 12-derivados-enzimas co-fatores e ligantes de proteínas e ácidos nucleicos. Chemical Society Reviews, 40 (8), 4346-4363.
- Murray, r. K., Granner, d. K., Mayes, p. PARA., & Rodwell, V. C. (2014). Bioquímica ilustrada de Harper. McGraw-Hill.
- Nelson, d. eu., Lehninger, a. eu., & Cox, M. M. (2008). Lehninger Principles of Biochemistry. Macmillan.
- Staiano, m., Pennacchio, a., Varrie, a., Capo, a., Majoli, a., Capacchione, c., & D'Auria, S. (2017). Enzimas como sensores. Em métodos em enzimologia (vol. 589, pp. 115-131). Academic Press.
- « Peticionário para o que é o uso, exemplo, formato (modelo)
- Respiração branquial como é feito e exemplos »

