Aldeído

- 4419
- 53
- Ernesto Bruen
Quais são os aldeídos?
O Aldeído Eles são compostos orgânicos que têm uma fórmula geral rcho. R representa uma cadeia alifática ou aromática; C carbono; Ou oxigênio e h hidrogênio. Eles são caracterizados por possuir um grupo carbonil, como cetonas e ácidos carboxílicos, de modo que os aldeídos também são chamados de compostos carbonil.
O grupo carbonil dá ao aldeído muitas de suas propriedades. São compostos que são facilmente oxidados e são muito reativos a adições nucleofílicas. A ligação dupla do grupo carbonil (C = O) apresenta dois átomos que têm diferenças de avidez por elétrons (eletronegatividade).
O oxigênio atrai elétrons mais fortemente que o carbono, então a nuvem eletrônica se move em direção a ele, fazendo a dupla ligação entre carbono e oxigênio da natureza polar, com um importante momento dipolar. Isso faz os aldeídos.
Em outras palavras, os aldeídos são um tipo de compostos orgânicos decorrentes da oxidação de certos álcoois.
Estrutura química dos aldeídos
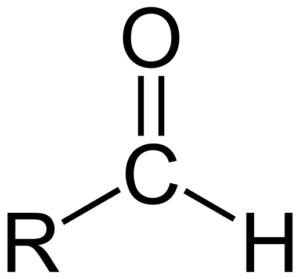 Estrutura química dos aldeídos
Estrutura química dos aldeídos Os aldeídos consistem em um carbonil (c = o) ao qual um átomo de hidrogênio está diretamente ligado. Isso o diferencia de outros compostos orgânicos, como cetonas (r2C = o) e ácidos carboxílicos (rcooh).
A imagem superior mostra a estrutura molecular ao redor do formil -CHO, grupo. O grupo formile é plano porque o carbono e o oxigênio têm hibridação SP2. Essa planaridade o torna suscetível ao ataque de espécies nucleófilas e, portanto, é facilmente oxidado.
O que significa essa oxidação? À formação de um vínculo com qualquer outro átomo eletronegativo que o carbono; E no caso de aldeídos, é um oxigênio. Assim, o aldeído oxida um ácido carboxílico, -coh. E se o aldeído fosse reduzido? Um álcool primário seria formado, roh.
Aldeídos ocorrem apenas de álcoois primários: aqueles em que o grupo OH está no final de uma corrente. Da mesma forma, o grupo de formil sempre É no final de uma corrente ou se destaca dela ou do anel como substituinte (se houver outros grupos mais importantes, como -Cooh).
Propriedades físicas e químicas dos aldeídos
Sendo compostos polares, seus pontos de fusão são maiores que os dos compostos não polares. As moléculas de aldeídos não são capazes de se ligar intermolecularmente por pontes de hidrogênio, por ter apenas átomos de carbono unidos a átomos de hidrogênio.
Devido ao exposto acima, os aldeídos têm pontos de ebulição mais baixos do que os álcoois e os ácidos carboxílicos.
Pontos de fusão
Formaldeído -92; Acetaldeído -121; PropionalDehyde -81; n- butaldeído -99; N -valeraldehyde -91; Caproaldeído -; Heptaldeído - 42; Fenilacetaldeído -; Benzaldeído -26.
Pontos de ebulição
Formaldeído -21; Acetaldeído 20; Propriedade de Hyd 49; N-butiraldehido 76; N-vlareraldeído 103; Caproaldeído 131; Heptaldeído 155; Fenilacetaldeído 194; Benzaldeído 178.
Pode atendê -lo: propriedades específicas da matéria: o que são e exemplosSolubilidade em água expressa em g/100 g de h2QUALQUER
Formaldeído, muito solúvel; acetaldeído, infinito; PropionalDeyde, 16; N-butiraldeído, 7; N-vlareraldeído, ligeiramente solúvel; Capraldeído, ligeiramente solúvel; Fenilacetaldeído ligeiramente solúvel; Benzaldeído, 0,3.
Os pontos de ebulição dos aldeídos tendem a aumentar diretamente com o peso molecular. Pelo contrário, há uma tendência a reduzir a solubilidade dos aldeídos na água à medida que seu peso molecular aumenta. Isso se reflete nas constantes físicas dos aldeídos recém -mencionados.
Reatividade dos aldeídos
Reação de oxidação
Os aldeídos podem oxidar o ácido carboxílico correspondente na presença de qualquer um desses compostos: Ag (NH3)2, Kmno4 OK2Cr2QUALQUER7.
Redução dos álcoois
Eles podem se hidrogenar com a ajuda de catalisadores de níquel, platina ou paládio. Assim, C = O é transformado em C-OH.
Redução para hidrocarbonetos
Na presença de Zn (Hg), HCl concentrado ou em NH2NH2 Os aldeídos perdem o grupo carbonil e se tornam hidrocarbonetos.
Adição nucleofílica
Existem vários compostos que são adicionados ao grupo carbonil, entre eles: Grignard, reagentes de cianeto, derivados de amônia e álcoois.
Nomenclatura dos aldeídos
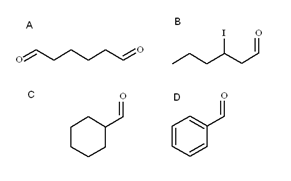 Quatro aldeídos. Fonte: Gabriel Bolívar
Quatro aldeídos. Fonte: Gabriel Bolívar Na imagem superior, quatro aldeídos são ilustrados. Como eles são nomeados?
Como são álcoois primários enferrujados, o nome do álcool é alterado a terminação -ol por -al. Assim, metanol (escolha3Oh) se oxidado para CHO3Cho é chamado metanal (formaldeído); CH3CH2Cho etanal (acetaldeído); CH3CH2CH2Cho Propanal e Cho3CH2CH2CH2Butanal Cho.
Todos os aldeídos recém -nomeados têm o grupo -Cho no final da cadeia. Quando isso é nas duas extremidades, como em a, no final -o prefixo di é adicionado a ele-. Como tem seis carbonos (contando os de ambos os grupos formil), deriva do 1-hexanol e seu nome é, portanto: hexanoDial.
Quando há um substituinte, como um radical alquílico, um link duplo ou triplo ou um halogênio, os carbonos da cadeia principal são listados, dando ao número 1. Assim, Aldeyde B é chamado: 3-iodhexanal.
No entanto, nos aldeídos C e D, o grupo -não tem prioridade para identificar esses compostos de outros. C é um cicloalcano, enquanto D a benzeno, ambos com um de seu H substituído por um grupo de formil.
Neles, como a estrutura principal é cíclica, o grupo de formil é chamado Carbaldeído. Assim, C é o ciclohexanocbaldeído e o benzenocarbaldeído (mais conhecido como benzaldeído).
Usos de aldeído
Existem aldeídos na natureza capaz de conferir sabores agradáveis, como é o caso do cinnamaldeído, responsável pelo sabor característico da canela. É por isso que eles geralmente são usados como aromas artificiais em muitos produtos, como doces ou comida.
Formaldeído
O formaldeído é o aldeído que ocorre industrialmente em maior quantidade. O formaldeído obtido pela oxidação do metanol é usado em uma solução de 37% de gás na água, sob o nome de formalina. Isso é usado no bronzeamento de peles e na conservação e embalsamamento de cadáveres.
Pode atendê -lo: acetato de sódio: estrutura, propriedades, síntese, usosO formaldeído também é usado como germicida, fungicida e inseticida para plantas e vegetais. No entanto, sua maior utilidade é a contribuição para a produção de material polimérico. O plástico chamado Bakelita é sintetizado pela reação entre o formaldeído e o fenol.
Bakelita
Bakelita é um grande polímero de estrutura dimensional difícil -hard usado em vários utensílios domésticos, como vasos de panelas, panelas, cafeteiras, facas, etc.
Polímeros semelhantes a Bakelita são feitos de formaldeído em combinação com compostos de uréia e melamina. Esses polímeros são usados não apenas como plásticos, mas também são usados como paus adesivos e material de revestimento.
Madeira compensada
O compensado é o nome comercial de um material formado por folhas finas de madeira, acompanhadas por polímeros produzidos a partir do formaldeído. As marcas fórmicas e melmac são fabricadas com a participação deste. O fórmico é um material plástico usado no revestimento de móveis.
O plástico mmlmac é usado na elaboração de placas, copos, xícaras, etc. O formaldeído é matéria-prima para a síntese do composto de metileno-difenil-diisocianato (MDI), precursor do poliuretano.
Poliuretano
O poliuretano é usado como isolador em geladeiras e congeladores, acolchoados para móveis, colchões, revestimentos, adesivos, solas, etc.
Butiraldeído
Butiraldeído é o principal precursor da síntese de 2-etilhexanol, que é usado como plastificante. Possui um agradável aroma de maçã que permite seu uso em alimentos como aromatizantes.
Também é usado para aceleradores de borracha. Ele intervém como um reagente intermediário na fabricação de solventes.
Acetaldeído
O acetaldeído foi usado na produção de ácido acético. Mas essa função do acetaldeído diminuiu em importância, pois foi deslocada pelo processo de carbonização de metanol.
Síntese
Outros aldeídos são precursores de oxoalcohols, que são usados na produção de detergentes. Os oxoalcohols tão chamados são preparados adicionando carbono e monóxido de hidrogênio a uma olefina para obter um aldeído. E finalmente o aldeído é hidrogênio para obter álcool.
Alguns aldeídos são usados na fabricação de perfumes, como o Chanel No. 5. Muitos aldeídos naturais têm odores agradáveis, por exemplo: o heptanal tem o cheiro de grama verde; o octanal, cheiro de laranja; O não anal, cheiro de rosas e citral, cheiro de lima.
Exemplos de aldeídos
Glutaraldeído
 Glutaraldeído. Fonte: por Jynto [CC0], da Wikimedia Commons
Glutaraldeído. Fonte: por Jynto [CC0], da Wikimedia Commons Glutaraldeído apresenta em sua estrutura dois grupos formil em ambas as extremidades.
Comercializado sob o nome de cidex ou glutararal, é usado como um desinfetante para esterilizar instrumentos cirúrgicos. É usado no tratamento de verrugas nos pés, aplicando -se como um líquido.
Também é usado como um agente de fixação de tecido em laboratórios de histologia e patologia.
Pode atendê -lo: sulfato de cobre (CUSO4): estrutura, propriedades, obtenção, usosBenzaldeído
É o aldeído aromático mais simples, formado por um anel benzeno onde um grupo de formil está ligado.
É encontrado em óleo de amêndoa, daí seu cheiro característico que permite seu uso como um sabor de alimento. Além disso, é usado na síntese de compostos orgânicos relacionados à fabricação de medicamentos e elaboração de plásticos.
Gliceraldeído
É um aldotriosa, um açúcar constituído por três átomos de carbono. Apresenta dois isômeros chamados d e l enantiomers. Glyceraldeyde é o primeiro monossacarídeo obtido na fotossíntese durante a fase escura (Calvin Cycle).
Gliceraldeído-3-fosfato
 Gliceraldeído. Fonte: Jynto e Ben Mills
Gliceraldeído. Fonte: Jynto e Ben Mills Na imagem superior, a estrutura do gliceraldeído-3-fosfato é ilustrada. As esferas vermelhas ao lado do amarelo correspondem ao grupo fosfato, enquanto preto para o esqueleto de carbono. A esfera vermelha ligada ao Blanca é o grupo OH, mas quando a esfera preta está ligada e a última ao branco, então é o grupo CHO.
O gliceraldeído-3-fosfato intervém na glicólise, um processo metabólico no qual a glicose é degradada no ácido pirúvico com a produção de ATP, um reservatório de energia dos seres vivos dos seres vivos. Além da produção do NADH, um agente redutor biológico.
Na glicólise glicoleraldeído-3-fosfato e di-hidroacetona de fosfato são causados pela d-frcease-6-6-bifasy-fosfato.
O gliceraldeído-3-fosfato intervém no processo metabólico conhecido como ciclo de pentose. Nisso, o NADPH é gerado, importante redutor biológico.
11 -cis -retinal
 11 -cis -retinal
11 -cis -retinal Β-caroteno é um pigmento natural presente em vários vegetais, especialmente na cenoura. Experimente uma quebra oxidativa no fígado, transformando -se em álcool de retinol ou vitamina A. A oxidação da vitamina A e a isomerização subsequente de uma de suas ligações duplas, forma o aldeído 11-retinal.
Fosfato piridoxal (vitamina B6)
 Fosfato piridoxal, ou vitamina B6. Fonte: Jynto e Ben Mills.
Fosfato piridoxal, ou vitamina B6. Fonte: Jynto e Ben Mills. É um grupo protético ligado a várias enzimas, que é a forma ativa de vitamina B6 e participa do processo de síntese do neurotransmissor inibidor GABA GABA.
Onde está o grupo de formil em sua estrutura? Observe que isso difere do restante dos grupos ligados ao anel aromático.
Salicilaldeído
É uma matéria -prima para a síntese de ácido acetilsalicílico, medicina analgésica e antipirética conhecida como aspirina.
Referências
- Robert c. Neuman, jr. Capítulo 13, compostos carbonil: cetonas, aldeídos, ácidos carboxílicos. [PDF]. Tirado de: química.Ucr.Edu
- Germán Fernández. (14 de setembro de 2009). Nomenclatura dos aldeídos. Retirado de: Chemicicaorganica.líquido
- T.C. Graham Solomons, Craight B. Fryhle. Química orgânica. (Décima edição, p 729-731) Wiley Plus.
- Jerry March e William H. Marrom. (31 de dezembro de 2015). Aldeído. Retirado de: Britannica.com
- Wikipedia. (2018). Aldeído. Retirado de: https: // em.Wikipedia.org/wiki/aldeído
- Morrison, r. T. E boyd, r. N. (1990). Química orgânica quinta edição. Editorial Addison-Wesley Iberoamericana.
- Carey, f. PARA. (2006). Química orgânica Sexta edição. MC Graw Hill Editorial.
- Mathews, cap. K., Van holde, k. E. E atern, k. G. (2002). Bioquímica. Terceira edição. Editorial Pearson Adisson Wesley.

