Agar Lia (Iron lysina) O que é, fundamento, preparação, usa
- 3735
- 1076
- Melvin Mueller
Ele Agar Lia (Iron lysina) É um teste bioquímico usado para a identificação de bactérias da família Enterobacteriaceae. Este meio foi criado por Edwards e Fife, baseado na fórmula de Falkow.
Originalmente, este teste era um caldo contendo Peptones, extrato de levedura, glicose, L-lisina, bromócresh e água destilada roxa. Edwards e Fife adicionaram agar-adagar, citrato férrico de amônio e tiossulfato de sódio.
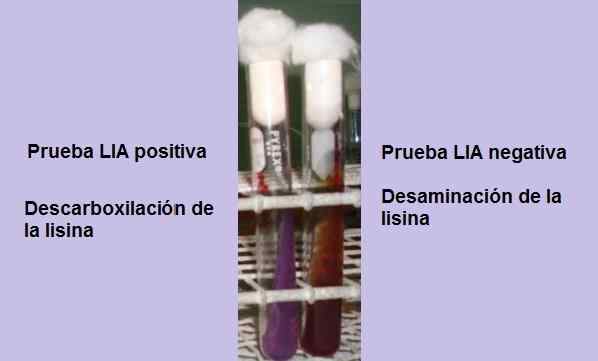
 Teste positivo e negativo de descarboxilação da lisina. Fonte: foto e esquema de propriedade do autor do MSC. Marielsa Gil
Teste positivo e negativo de descarboxilação da lisina. Fonte: foto e esquema de propriedade do autor do MSC. Marielsa Gil O teste consiste basicamente em demonstrar a presença da enzima rudboxilase, capaz de reagir com o grupo carboxil do aminoácido L-Lisin. Uma desaminação do aminoácido também pode ocorrer devido à presença da enzima lisina desgosto.
Além disso, a composição do meio permite demonstrar a capacidade de alguns gêneros bacterianos de produzir sulfeto de hidrogênio. Finalmente, também é possível observar a geração ou não de gás no meio.
Base
Peptonas e extrato de levedura
Como a maioria dos meios de cultivo, o ágar de ferro da lisina contém componentes que fornecem a fonte de nutriente necessária para o crescimento bacteriano. Esses componentes são representados por peptones e extrato de levedura.
Glicose
Da mesma forma, este ágar contém como glicose de carboidratos fermentáveis. Sabe -se que todas as bactérias da família Enterobacteriaceae fermentam a glicose.
Esta etapa é crucial, porque será responsável por acidificar o ambiente, uma condição indispensável para a enzima lisina descarboxilase - se estiver presente - age em seu substrato.
Em alguns gêneros bacterianos, a produção de gás pode ser observada devido à fermentação da glicose.
O gás é evidenciado quando um deslocamento do ágar occ.
Pode atendê -lo: biomateriaisL-Lisina
Uma vez que a lisina é descarboxilada, é formada uma diamina (cadaverina) e anidrido carbônico.
Inclutante ocorre na presença da coenzima fosfato piridoxal. Esta reação é irreversível.
Indicador de pH (roxo de bromocresol)
Todas as mudanças de pH ocorreram no meio pelas várias reações, são detectadas pelo indicador de pH do pH do bromocresol.
Nesse sentido, quando há acidificação, o meio se torna amarelo e quando há alcalização, o meio retorna à cor roxa ou roxa original.
Quando o desgosto da lisina ocorre devido à presença da enzima lisina, uma cor avermelhada é formada na superfície, típica no proteus, providência e algumas espécies de Morganella.
Isso se deve ao fato de que, durante o processo de desaminação, o ácido alfa-zo-carbônico é formado, o que reage com citrato de amônio na presença de oxigênio, o que causa a cor mencionada acima mencionada.
Citrato férrico de amônio e tiossulfato de sódio
Por outro lado, bactérias que produzem sulfeto de hidrogênio serão evidências2S.
As bactérias que têm a enzima reduzida do tiossulfato têm a capacidade de agir reduzindo o atual tiossulfato de sódio, formando sulfito e sulfeto de hidrogênio (H2S).
Este último é um gás incolor, mas ao reagir com o sal de sal de ferro, sulfeto metálico, que é um composto insolúvel (precipitado preto visível).
No entanto, a capacidade de treinamento de H2S com este meio não é muito confiável, porque algumas bactérias descarboxilase negativas capazes de produzir H2S não formará o precipitado negro, porque a acidez do meio interfere. Portanto, é recomendável corroborar com outros meios contendo ferro.
Pode atendê -lo: neurôniosInterpretação do teste
Recboxilação da lisina
Os tubos devem ser lidos após concluídos 24 horas de incubação, caso contrário, há um risco de entender mal a reação, relatando falsos negativos.
Lembre -se de que a primeira reação que ocorrerá será a fermentação da glicose; portanto, todos os tubos após 10 a 12 horas ficarão amarelos.
Se no final do tempo de incubação (24 horas), há um fundo amarelo com uma superfície roxa ou roxa, a reação é negativa. A cor roxa da superfície corresponde à alcalização do meio pelo uso de peptones.
Uma reação positiva é que onde a parte inferior e a superfície do tubo são completamente roxas, ou seja, ele retorna à cor original.
Portanto, quem determina a positividade do teste é a base ou o fundo do meio. Se você tem dúvidas sobre a cor, ela pode ser comparada com um tubo de Lia não inoculado.
Desaminação de lisina
Um tubo que mostra o desgosto da lisina terá uma superfície avermelhada de granada e um fundo amarelo (ácido), ou todo o tubo avermelhado Garnet Reddish.
Essa reação é interpretada como negativa para a descarboxilação da lisina, mas positiva para a desaminação lisina.
Esta reação é definida e interpretada no chanfro.
Produção de sulfeto de hidrogênio (H2S)
Uma reação positiva é observada pelo aparecimento de um precipitado negro em todo o meio ou parte dele. Geralmente entre o limão da moldura e a base.
Se o precipitado ocorrer em todo o tubo, não será visto as outras reações que ocorrem no meio.
Registro de resultados
Ao interpretar o teste, os resultados são registrados da seguinte forma:
Pode atendê -lo: Miller e Urey ExperiencePrimeiro, o painel é lido, depois o fundo ou taco, depois a produção de h2S, e finalmente produção de gás.
Exemplo: K/A + (-). Isso significa:
- K: Mungor alcalino (cor roxa)
- A: fundo ácido (amarelo), isto é, reação negativa de descarboxilação e desgosto negativo.
- +: Produção de sulfeto de hidrogênio
- (-): sem gás.
Preparação
Pesa 35 gr do deitoso de ferro médio desidratado e se dissolve em um litro de água destilada.
Quente até dissolver completamente o ágar, ferver por um minuto acenando com frequência. Distribua 4 ml do meio em 13/100 tubos de teste com tampa de algodão.
Esterilize em autoclave a 121 ° C por 15 minutos. Remova da autoclave e deixe inclinar o suporte, para que haja uma base profunda e um chanfro curto.
Armazene em uma geladeira de 2-8 ° C. Deixe um temperamento antes de semear a tensão bacteriana.
A cor do meio desidratado é bege e o meio roxo avermelhado preparado.
O pH final do meio preparado é de 6,7 ± 0.2
O meio fica amarelo com pH igual ou inferior a 5,2 e é roxo a pH 6,5 up.
Formulários
Este teste, juntamente com outros testes bioquímicos, é usado para a identificação de bacilos da família Enterobacteriaceae.
O meio é semeado com uma reta ou agulha, uma ou duas punções são feitas no fundo do tubo e, em seguida, a superfície do meio em zigue -zague.
É incuba por 24 horas a 35-37 ° C em aerobiose. Se necessário, é deixado incubando por 24 horas mais.
É principalmente útil para diferenciar espécies negativas de citrobacter de Salmonellas sp.
Referências
- Mac Faddin J. (2003). Testes bioquímicos para a identificação de bactérias de importância clínica. 3ª ed. Editorial pan -americano. bons ares. Argentina.
- Forbes B, Sahm D, Weissfeld A. (2009). Diagnóstico microbiológico de Bailey & Scott. 12 ed. Pan -American Editorial S.PARA. Argentina.

