Características de actina, estrutura, filamentos, função
- 3729
- 660
- Tim Mann
O Actina É uma proteína citosólica que forma microfilamentos. Nos eucariotos, a actina é uma das proteínas mais abundantes. Por exemplo, representa 10% em peso da proteína total nas células musculares; e entre 1 e 5% da proteína em células não musculares.
Esta proteína, ao lado dos filamentos e microtúbulos intermediários, forma o citoesqueleto, cuja principal função é a mobilidade da célula, a manutenção da forma celular, a divisão celular e o movimento de organelas em plantas, fungos e animais.
 Fonte: sarcômere.SVG: David Richfield (Usuário de Slashme) Trabalho derivado: Retama [CC BY-SA 3.0 (http: // criativecommons.Org/licenças/BY-SA/3.0/]]
Fonte: sarcômere.SVG: David Richfield (Usuário de Slashme) Trabalho derivado: Retama [CC BY-SA 3.0 (http: // criativecommons.Org/licenças/BY-SA/3.0/]] Isoformas de citoesquelet de actina.
Do ponto de vista evolutivo, a actina é uma proteína altamente preservada. Existem cerca de 90% de homologia de sequência em diferentes espécies. Em organismos unicelulares, um único gene codifica uma forma de actina. Enquanto em organismos multicelulares, diferentes genes codificam várias formas de actina.
A actina, juntamente com a miosina, eram estruturas cruciais no futuro evolutivo dos organismos eucarióticos e sua diversificação, uma vez que permitiram movimento na ausência de outras estruturas, como flagelos e cílios.
[TOC]
Estrutura: filamentos de actina
A actina é uma única proteína globular da cadeia polipeptídica. No músculo, a actina tem uma massa molecular de aproximadamente 42 kDa.
Esta proteína tem dois domínios. Cada um tem dois subdomínios e uma fenda entre os domínios. O ATP-MG+2 Junta -se ao fundo da fenda. Os terminais amino e carboxil se reúnem no subdomínio 1.
Actina G e Actina F
Existem duas formas principais de actina: o monômero de actina, chamado Actina G; e um polímero filamentoso, composto de monômeros de actina G, chamados Actina F. Os filamentos de actina, observados por microscopia eletrônica, têm regiões estreitas e amplas, respectivamente 7 nm e 9 nm de diâmetro.
Ao longo do filamento, os monômeros de actina formam uma hélice dupla espremida. Uma unidade repetida em todo o filamento consiste em 13 hélices e 28 monômeros de actina, e tem uma distância de 72 nm.
O filamento de actina tem dois fins. Um forma a fenda que conecta o ATP-MG+2, que está localizado na mesma direção em todos os monômeros de actina do filamento, chamados de fim (-); E a outra extremidade é o oposto, chamado de final (+). Portanto, diz -se que o filamento de actina tem polaridade.
Muitas vezes esses componentes são conhecidos como microfilamentos, pois são os componentes do citoesqueleto que apresentam menos diâmetro.
Onde encontramos actina?
A actina é uma proteína extremamente comum em organismos eucarióticos. De todas as proteínas celulares, a actina representa cerca de 5 a 10% - dependendo do tipo de célula. No fígado, por exemplo, cada uma das células que constituem tem quase 5.108 Moléculas de actina.
Caracteristicas
As duas formas de actina, monômero e filamento são continuamente encontradas em um equilíbrio dinâmico entre polimerização e despolímeros. Em geral, existem três características desse fenômeno:
1) Os filamentos de actina são típicos da estrutura do tecido muscular e do citoesqueleto de células eucarióticas.
Pode atendê -lo: as 10 características dos lipídios mais destacados2) Polimerização e despolimerização é um processo dinâmico que é regulado. Onde a polimerização ou agregação de monômeros de actina G-ATP-MG+2 Isso acontece nas duas extremidades. Que esse processo ocorre depende das condições do meio e das proteínas reguladoras.
3) A formação de vigas e retículos, que compõem o citoesqueleto de actina, dá força à motilidade celular. Isso depende de proteínas que participam da formação de ligações cruzadas.
Funções
Contração muscular
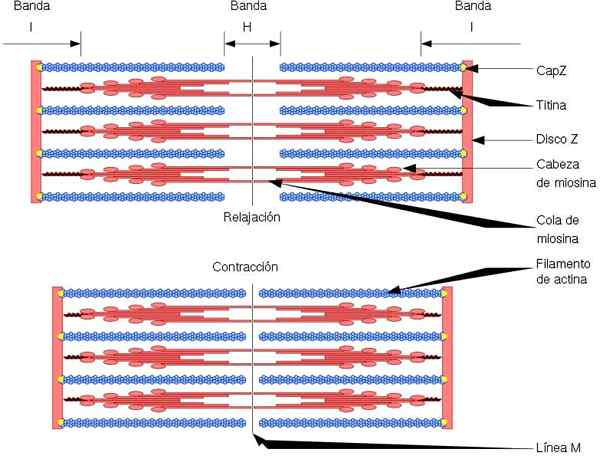
A unidade funcional e estrutural do músculo esquelético é o sarcomer, que possui dois tipos de filamentos: filamentos finos, formados por actina e filamentos grossos, formados por miosina. Ambos os filamentos são organizados alternadamente, de uma maneira geométrica precisa. Permitir contração muscular.
Filamentos finos estão ancorados em regiões chamadas discos z. Esta região consiste em uma rede de fibras, na qual a proteína Capz está localizada e para a qual as extremidades (+) dos filamentos de actina são ancoradas. Esta âncora impede a despolerização final (+).
Por outro lado, nas extremidades (-) dos filamentos de actina, a tropomodulina está localizada e os protege da despolímeragem. Além da actina, os filamentos finos têm tropomiosina e troponina, que têm a função de controlar as interações actomiosina.
Como ocorre a contração muscular?
Durante a contração muscular, os filamentos grossos fazem movimentos de pivô e puxam os filamentos finos para o meio do sarcômer. Isso produz o deslizamento das fibras grossas e finas.
Assim, o comprimento dos filamentos grossos e finos permanece constante, mas aumenta a sobreposição entre os dois filamentos. O comprimento do sarcomer diminui pela ancoragem de filamentos finos nos discos Z.
Como a contração muscular para?
ATP é a moeda energética da célula. Portanto, quase sempre está disponível nos tecidos musculares vivos. Levando em conta o exposto, deve haver mecanismos que permitam relaxamento muscular e prisão das contrações.
Duas proteínas, chamadas tropomiosina e troponina, têm um papel fundamental nesse fenômeno. Eles trabalham juntos para bloquear os sites sindicais da miosina (impedindo sua união com a actina). Como resultado, o músculo relaxa.
Ao contrário, quando um animal morre experimenta um fenômeno conhecido como mortis rigor. A pessoa responsável por esse endurecimento do corpo é o bloqueio da interação entre miosina e actina, logo após a morte do animal.
Uma das conseqüências desse fenômeno é a necessidade de ATP para a liberação das duas moléculas de proteína. Logicamente, não há disponibilidade de ATP em tecidos mortos e este lançamento não pode ocorrer.
Outros tipos de movimento
O mesmo mecanismo que descrevemos (mais tarde aprofundaremos o mecanismo subjacente ao movimento) não se restringe às contrações musculares dos animais. Ele é responsável pelos movimentos amebidais que observamos nas amebas e em alguns moldes coloniais.
Da mesma maneira, o movimento citoplasmático que observamos em algas e plantas terrestres é liderado por mecanismos semelhantes.
Regulação da polimerização e despolimerização do filamento de actina
A contração do tecido muscular liso e as células produz um aumento da actina f e uma diminuição na actina G. A polimerização de actina ocorre em três estágios: 1) nucleação, um passo lento; 2) alongamento, um passo rápido; e 3) status estável. A velocidade de polimerização é igual à taxa de despolimerização.
Pode atendê -lo: teoria fixista: conceito, postula e autoresO filamento de actina cresce mais rápido até o final (+) do que o final (-). A velocidade de alongamento é proporcional à concentração de monômeros de actina em equilíbrio com filamentos de actina, chamados de concentração crítica (CC).
O CC para a extremidade (+) é de 0,1 µm e para o fim (-) é de 0,8 µm. Isso significa que 8 vezes menos concentração de monômeros de actina é necessária para polimerizar o fim (+).
A polimerização de actina é regulada principalmente por golpes beta4 (TB4). Esta proteína une a actina G e a retém, impedindo o polimerício. Enquanto a propilina estimula a polimerização da actina. O perfil se liga aos monômeros de actina, facilitando a polimerização até o final (+), por dissociação do complexo Actin-TB4.
Outros fatores, como o aumento de íons (NA+, K+ ou mg+2) favorece a formação de filamentos.
Formação do citoesqueleto de actina
A formação do citoesqueleto de actina requer a elaboração de títulos cruzados entre os filamentos de actina. Esses vínculos formam proteínas, cujos destaques são: eles têm domínios da união para actina; Muitos têm domínios homólogos para a calponina; e cada tipo de proteína é expresso em um certo tipo de célula.
Nos filópodes e fibras de estresse, os títulos cruzados entre os filamentos de actina são feitos por fascina e filamina. Essas proteínas, respectivamente, tornam os filamentos de actina paralelos ou têm ângulos diferentes. Portanto, os filamentos de actina definem a forma da célula.
A região celular com a maior quantidade de filamentos de actina está localizada perto da membrana plasmática. Esta região é chamada de córtex. O citoesqueleto cortical é organizado de diferentes formas, dependendo do tipo de célula, e se conecta à membrana plasmática através de proteínas de fixação.
Alguns dos melhores citoesqueletos descritos são células musculares, plaquetas, células epiteliais e eritrócitos. Por exemplo, em células musculares, a proteína fixadora de distrofina se une a filamentos de actina a um complexo glicoproteico abrangente da membrana. Este complexo se liga às proteínas da matriz extracelular.
Modelo de interação de actina-miosina
Pesquisadores liderados por raio propuseram um modelo de quatro etapas para explicar a interação de actina e miosina. O primeiro passo ocorre com a união do ATP para as cabeças de miosina. Esta união gera uma mudança conformacional na proteína, liberando -a da actina no pequeno filamento.
Então, o ATP é hidrolisado para ADP, liberando um fosfato inorgânico. A molécula de miosina está ancorada em uma nova subunidade de actina, gerando um estado de alta energia.
A liberação de fosfato inorgânico traz consigo uma mudança na miosina, retornando à conformação inicial e ao movimento dos pequenos filamentos, com relação aos filamentos grossos, com relação aos filamentos grossos. Este movimento causa o movimento das duas extremidades do sarcômer, aproximando -se deles.
A última etapa envolve o lançamento de ADP. Neste ponto, a cabeça da miosina é gratuita e pode se juntar a uma nova molécula ATP.
Pode servir a você: Biologia: História, que estudos, ramificações, basesMovimento celular impulsionado pela polimerização de actina
A motilidade reitor é um tipo de motilidade celular. As etapas desse tipo de motilidade são: projeção do eixo principal de adesão ao substrato; adesão ao substrato; retração traseira; e des-adesão.
A projeção do eixo principal requer a participação de proteínas, que participam da polimerização e despolimerização dos filamentos de actina. O eixo principal está localizado no córtex celular, chamado Lamellipodio. As etapas de projeção do eixo são:
- Ativação do receptor por sinal extracelular.
- Formação de GTPasas ativo e fosfoinositol de 4,5 bisosfato (PIP2).
- A ativação da proteína WASP/SCAR e ARP2/3, que se ligam aos monômeros de actina para formar ramificações nos filamentos de actina.
- Rápido crescimento dos filamentos de actina, no final decorado com miosina, ramificando. O impulso da membrana é produzido para a frente.
- Culminar do alongamento produzido por proteínas de capa.
- Hidrólise ATP ligada à actina nos filamentos mais antigos.
- Despolimerização do actina-ad dos filamentos promovidos pelo ADF/Cofilina.
- Troca ADP por ATP catalisado por profilina, gerando actina G-ATP pronta para iniciar ramificações Elongar.
Doenças relacionadas à actina
Distrofia muscular
Distrofia muscular é uma doença degenerativa do músculo esquelético. É herdado de forma recessiva e está ligada ao cromossomo X. Afeta principalmente homens com alta frequência na população (um em 3.500 homens). As mães desses homens são heterozigotas assintomáticas e podem não ter história familiar.
Existem duas formas de distrofia muscular, Duchenne e Becker, e ambas são causadas por defeitos no gene da distrofina. Esses defeitos consistem em deleções que eliminam axônios.
A distrofina é uma proteína (427 kDa) que forma ligações cruzadas entre filamentos de actina. Tem um domínio da união para agir no terminal N e um domínio da união de membrana no terminal C. Entre os dois domínios, há um terceiro domínio tubular formado por 24 repetições em tandem.
No retículo cortical muscular, a distrofina participa da união dos filamentos de actina para a membrana plasmática através de um complexo glicoproteico. Este complexo também se liga às proteínas da matriz extracelular.
Em pacientes que não têm distrofina funcional, com a distrofia muscular de Duchenne, o citoesqueleto cortical não suporta a membrana plasmática. Consequentemente, a membrana plasmática é danificada pelo estresse de repetidas contrações musculares.
Referências
- Devlin, t.M. 2000. Bioquímica. Editorial Reverté, Barcelona.
- Armas, s.J., e Zhang, W. 2008. Dinâmica citoesquelética de actina no músculo liso: um novo paradigma para a regulação da contração do músculo liso. Am J Physiol Cell Physiol, 295: C576-C587.
- Lodish, h., Berk, a., Zipurski, s.eu., Matsudaria, p., Baltimore, d., Darnell, J. 2003. Biologia celular e molecular. Medica editorial Panamericana, Buenos Aires, Bogotá, Caracas, Madri, México, Sāo Paulo.
- Nelson, d. eu., Cox, m. M. 2008. Lehninger-princípios da bioquímica. C.H. Freeman, Nova York.
- Pfaendtner, J., Da cruz e. M., Voth, g. 2010. Remodelação do filamento de actina pelo fator de despolimerização por actina/cofilina. PNAS, 107: 7299-7304.
- Pollard, t.D., Borisy, g.G. 2003. Motilidade celular acionada pela montagem e desmontagem dos preenchimentos de actina. Cell, 112: 453-465.
- « Apolipoproteínas O que são, funções, tipos
- Estrutura primária de álcool, propriedades, nomenclatura, exemplos »

