Estrutura, funções e inibidores da acetilcolinesterase
- 4018
- 44
- Lonnie MacGyver
O acetilcolinesterase (Acetilcolina acetilsa hidrolese, EC 3.1.1.7) É uma enzima que está principalmente no sistema nervoso central. Sua tarefa, como o nome indica, é o processamento hidrolítico do neurotransmissor de acetilcolina.
É uma enzima associada à membrana celular que trabalha em conjunto com o receptor de acetilcolina para mediar a excitação de células pós -sinápticas e cujo mecanismo catalítico é surpreendentemente rápido.
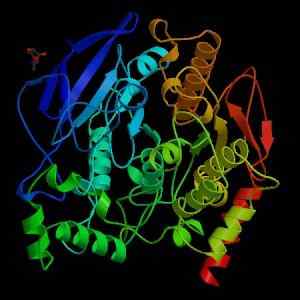
 Estrutura da acetilcolinesterase (Fonte: Wikimedia Commons)
Estrutura da acetilcolinesterase (Fonte: Wikimedia Commons) Do ponto de vista mecânico, essa enzima pode ser vista como uma serin-hidrolase e, no domínio catalítico de seu local ativo, contém a tríade de aminoácidos característicos das proteases: serina, histidina e um resíduo ácido. No entanto, o resíduo ácido é um glutamato, enquanto as proteases normalmente têm um aspartato.
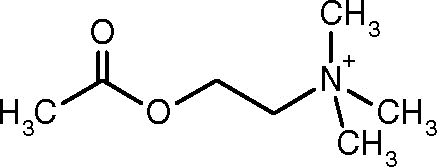 Estrutura de acetilcolina (Fonte: Alinebloom [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)] via Wikimedia Commons)
Estrutura de acetilcolina (Fonte: Alinebloom [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)] via Wikimedia Commons) Uma das primeiras observações que ligava a atividade catalítica da acetilcolinesterase a tecidos nervosos colinérgicos e tecidos musculares foi feita por Dale em 1914; Posteriormente, foi determinado que também está presente em neurônios não colóricos e em células hematopoiéticas, osteogênicas e neoplásicas.
Graças ao estudo de vários organismos, sabe -se atualmente que a enzima está presente na membrana de diferentes tipos de células, como eritrócitos, células nervosas e musculares, órgãos elétricos e outros.
[TOC]
Estrutura
Estrutura terciária e quaternária
Em condições naturais ou "na Vivo ", A acetilcolinesterase é uma enzima polimórfica que consiste em várias subunidades catalíticas de mais ou menos 80 kDa, que são montados para formar uma estrutura oligomérica (de várias subunidades).
A quantidade e a complexidade dessas subunidades depende do tipo de célula e das espécies que são consideradas.
Algumas das formas enzimáticas mais complexas têm subunidades catalíticas com formas globulares (g) ou assimétricas (a) ligadas por pontes dissulfeto. As pontes dissulfeto são ligações covalentes formadas entre duas moléculas de enxofre dos grupos Tiol (-SH) de dois resíduos do ácido do código da cisteína ácido.
Cada Subunidad G contém um único local ativo, enquanto as subunidades A geralmente são caracterizadas por apresentar três domínios estruturais, a saber: subunidades catalíticas, caudas de colágeno ricas em glicina, hidroxiprolina e resíduos de hidroxilisina e outras caudas não colagênicas (diferentes de colágeno).
As formas assimétricas de acetilcolinesterase são conhecidas como A12, A8 e A4, que possuem subunidades catalíticas 12, 8 e 4, respectivamente, respectivamente.
Pode servir você: flora e fauna da África: espécies representativasGeralmente, os resíduos do domínio catalítico no local ativo estão em uma região "profunda" das subunidades, que pode ser vista como contraditória em relação à rápida velocidade da reação que catalisa essa enzima e a aparente inacessibilidade do substrato a esses sites.
Independentemente do polimorfismo enzimático, as subunidades globulares e assimétricas têm atividades catalíticas semelhantes.
Variantes
Algumas células além de células nervosas, como os eritrócitos produzem enzimas acetilcolinest predominantemente globulares, dimétricas e principalmente associadas à face externa da membrana plasmática.
A enzima dos eritrócitos, embora de menos complexidade estrutural, também é uma enzima anfipática, cujo domínio catalítico ativo é encontrado na grande região hidrofílica, enquanto o domínio hidrofóbico, que contém a região de carboxil terminal, é responsável por sustentá -lo na membrana.
Estrutura primária
Grande parte do conhecimento atual sobre a sequência de acetilcolinesterase surgiu do estudo da enzima de Torpedo californica, Um peixe de linha que vive no Oceano Pacífico e que é tradicionalmente usado como organismo modelo para o estudo de diferentes proteínas do sistema nervoso.
As subunidades da acetilcolinesterase são sintetizadas como pró-proteínas que são processadas para dar origem a subunidades maduras. Cada subunidade consiste em um polipeptídeo de cerca de 575 aminoácidos e peso molecular de 65 kDa, o que aumenta com a adição de 7-8% de resíduos de carboidratos (glicosilação).
A atividade catalítica do local ativo das subunidades é determinada por um resíduo de serina na posição 200, que está em uma região "profunda" das subunidades catalíticas.
Diferentes variantes ou isoformas da enzima existem em organismos graças a diferentes lugares para o "Splicing alternativo " Dos mensageiros pré-escravos em ambos os fins (5 'e 3'). A sequência carboxil-terminal da isoforma de cada subunidade é aquela que determina a montagem dos oligômeros entre si.
Funções
A acetilcolinesterase é uma enzima com múltiplas funções biológicas não necessariamente relacionadas entre si. Feito atestado por sua expressão diferencial durante a embriogênese, extensão neural embrionária, desenvolvimento muscular e sinioptagênese.
Como previamente enfatizado, tem uma função importante na rápida hidrólise da acetilcolina e, portanto, na regulação de seu efeito no espaço sináptico neuromuscular ou nos espaços sinápticos colóricos do sistema nervoso central do sistema nervoso central.
Pode atendê -lo: aplicações de biologia no gadoUm exemplo de suas funções é a contração do músculo esquelético, que ocorre graças a um tipo de sinapse química conhecida como placa motor, localizada entre um neurônio motor e uma fibra muscular.
Nesta sinapse centenas de vesículas carregadas com acetilcolina são alcançadas, que são liberadas do neurônio motor para a propagação de um impulso elétrico.
Esse processo de neurotransmissão é bastante complexo, no entanto, a participação da acetilcolinesterase é crucial para o término da transmissão sináptica que depende do neurotransmissor de acetilcolina, pois deve ser degradado e depois disseminar fora da falha sináptica para concluir com a excitação da membrana.
Assim, a enzima acetilcolinesterase é responsável por regular a concentração deste transmissor na sinapse neuromotora.
Outras funções “não -clássicas” da enzima estão relacionadas à neuritogênese ou crescimento de células nervosas; Com processos de adesão celular, sinaptogênese, ativação de neurônios-dopamina na substância negra do mesencéfalo, processos hematopoiéticos e poético de trombos, entre outros.
Inibidores
Os inibidores da acetilcolinesterase que são hidrolisados à acetilcolina, aumentando assim o nível e a duração da ação desse neurotransmissor. Eles podem ser classificados, de acordo com seu mecanismo de ação, como reversível e irreversível.
Inibidores irreversíveis
São aqueles que inibem irreversivelmente a atividade hidrolítica da acetilcolinesterase devido à sua junção covalente ao resíduo de serina no local ativo da enzima. Este grupo é composto principalmente de organofosfato.
Em geral, esses são compostos ativos presentes em muitos inseticidas e são responsáveis por um grande número de mortes acidentais devido a envenenamento. São ésteres ou tiíola derivados de ácido fosfórico, fosfônico, fosfina ou fosforamídico.
Sarin, Tabun, Soman e Cyclosarina estão entre os compostos mais tóxicos sintetizados pelo homem, pois podem matar um ser humano induzindo falhas respiratórias e circulatórias devido ao bloqueio da acetilcolinesterase no sistema nervoso periférico.
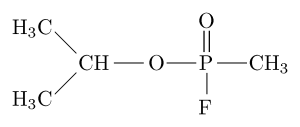 Estrutura molecular do inibidor da organofosfato “Sarín” (fonte: Sivizius [domínio público] via Wikimedia Commons)
Estrutura molecular do inibidor da organofosfato “Sarín” (fonte: Sivizius [domínio público] via Wikimedia Commons) Sarin, por exemplo, é um "gás nervoso" que foi usado como uma arma química para uso terrorista.
Inibidores reversíveis
Esta ordem dos grupos de classificação Inibidores competitivos e não competitivos que trabalham através da carbamilação transitória e reversível de um resíduo de serina no local ativo e muitos foram sintetizados e purificados a partir de fontes de planta ou fungos.
Pode servir a você: Sokes: características, estrutura, funçõesCarbamatos como fisostigmina e neostigmina são inibidores reversíveis que são usados como medicamentos para o tratamento de doenças como glaucoma e miastênia gravis, respectivamente.
Outros agentes terapêuticos deste grupo também são usados para o tratamento da doença de Alzheimer, Parkinson de Parkinson, Obstruções intestinais pós-operatórias (íleo pós-operatório), distensão da bexiga e antídotos para overdose com anticolinérgicos.
Butirilcolinesterase
Um mecanismo natural interessante contra algumas substâncias inibitórias da acetilcolinesterase tem a ver com a participação de uma enzima menos específica conhecida como butirilcolinesterase.
Esta enzima também é capaz de hidrolyz.
Doença de acetilcolinesterase e Alzheimer
Foi demonstrado que a acetilcolinesterase forma um complexo estável com os componentes das características seniles da patologia. Além disso, alguns padrões alterados de glicosilação desta enzima têm sido relacionados à presença e formação de placas amilóides no cérebro.
Muitos dos inibidores reversíveis da acetilcolinesterase, portanto, foram usados como medicamentos de primeira geração para o tratamento desta doença e outras condições neurodegenerativas relacionadas. Entre eles estão donepezilo, rivastigmina e galantamina.
Referências
- Dvir, h., Silman, i., Harel, m., Rosenberry, t. eu., & Sussman, J. eu. (2010). Acetilcolinesterase: da estrutura 3D para a função. Interações químicas-biológicas, 187, 10-22.
- Houghton, p., Ren, e., & Howes, M. (2006). Inibidores de acetilcolinesterase de plantas e fungos. Relatórios de produtos naturais, 23, 181-199.
- Krsti, d. Z., Lazarevi, t. D., Bond, a. M., & Vasi, V. M. (2013). Inibidores de acetilcolinesterase: farmacologia e toxicologia. Neurofarmacia atual, onze, 315-335.
- Mukherjee, p. K., Kumar, v., Ruim, m., & Houchton, P. J. (2007). Inibidores de acetilcolinesterase de plantas. Fitomedicina, 14, 289-300.
- Quinn, d. M. (1987). Acetilcolinesterase: estrutura enzimática, dinâmica de reação e estados de transição virtual. Chem. Rev., 87, 955-979.
- Racchi, m., Mazzucchelli, m., Porrello, e., Lanni, c., & Govoni, S. (2004). Inibidores de acetilcolinesterase: novas atividades de moléculas antigas. Pesquisa farmacológica, cinquenta, 441-451.
- Rosenberry, t. (1975). Acetilcolinesterase. Avanços em enzimologia e áreas relacionadas de biologia molecular, 43, 103-218.
- Dorq, h., & Seidman, S. (2001). Acetilcolinesterase - novos papéis para um velho ator. Revisões da natureza, 2, 294-302.
- Contos, v. N. (2001). Acetilcolinesterase na doença de Alzheimer. Mecanismos de envelhecimento e desenvolvimento, 122, 1961-1969.
- « Características da ribulosa, estrutura e funções
- 14 tipos de contrato de trabalho e suas características »

