50 exemplos de ácidos e bases

- 4792
- 1068
- Mr. Reginald Lindgren
Existem centenas Exemplos de ácidos e bases Isso pode ser encontrado em todos os ramos da química, mas que, como um todo, eles são separados em duas famílias grandes: inorgânicas e orgânicas. Os ácidos inorgânicos são geralmente conhecidos como ácidos minerais, caracterizados por serem especialmente fortes em comparação com orgânicos.
Ácidos e bases são entendidos como substâncias que têm sabores agrogados ou saponácoes, respectivamente. Ambos são corrosivos, embora a palavra 'cáustico' seja geralmente usada para bases fortes. Em contas de resumo: eles queimam e executam a pele se tocam. Suas características na mídia solvente programaram uma série de definições ao longo da história.
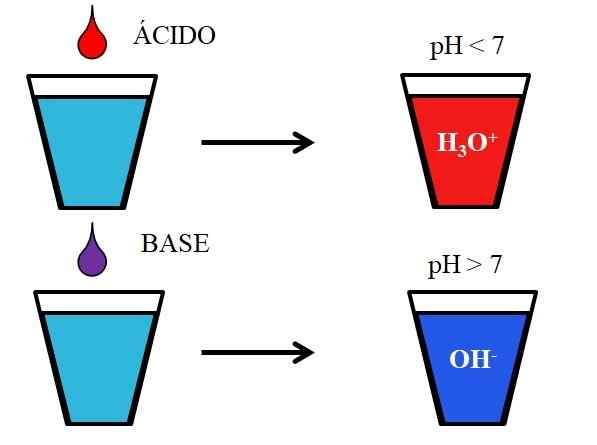 Comportamento de ácidos e bases quando dissolvido em água. Fonte: Gabriel Bolívar.
Comportamento de ácidos e bases quando dissolvido em água. Fonte: Gabriel Bolívar. A imagem inferior mostra o comportamento genérico de ácidos e bases quando são adicionados ou dissolvidos em um vidro com água. Os ácidos produzem soluções com valores de pH abaixo de 7 devido a íons hidronios, h3QUALQUER+; Enquanto as bases produzem soluções com pH acima de 7 devido a íons hidroxila (ou oxydril), OH-.
Se adicionarmos ácido clorídrico, HCl (gota vermelha), ao vidro, haverá íons h3QUALQUER+ e cl- hidratado. Por outro lado, se repetirmos o experimento com hidróxido de sódio, NaOH (gota roxa), teremos íons OH- e na+.
[TOC]
Definições

As características, cada vez mais estudadas e compreendidas, de ácidos e bases estabelecem mais de uma definição para esses compostos químicos. Entre essas definições, temos a de Arhenius, a de Bronsted-Lowry, e finalmente a de Lewis. Antes de citar os exemplos, é necessário ter esse claro.
Arrhenius
Ácidos e bases, segundo Arrhenius, são aqueles que se dissolvam em água produzem íons h3QUALQUER+ ou oh-, respectivamente. Isto é, a imagem já representa esta definição. No entanto, por si só, despreza alguns ácidos ou bases muito fracos para produzir esses íons. É aqui que a definição de Bronsted-Lowry entra.
Pode atendê -lo: ácidos: características e exemplosBronsted-Lowry
Os ácidos Bronsted-Lowry são aqueles que podem doar íons h+, E as bases são aquelas que aceitam essas+. Se um ácido doa muito facilmente+, Isso significa que é um ácido forte. O mesmo vale para as bases, mas aceitando H+.
Assim, temos ácidos e bases fortes ou fracos, e suas forças são medidas em diferentes solventes; especialmente na água, da qual as unidades de pH conhecidas são estabelecidas (de 0 a 14).
Portanto, um ácido forte doará completamente seu h+ à água em uma reação do tipo:
Ha + h2O => A- + H3QUALQUER+
Para onde- É a base conjugada de ha. Daqui, vem o h3QUALQUER+ presente no vidro com solução ácida.
Enquanto isso, uma base B fraca desprotege a água para ganhar seu respectivo h+:
B + h2Ou hb + oh-
Onde hb é o ácido conjugado de b. Este é o caso da amônia, NH3:
NH3 + H2Ou NH4+ + Oh-
Uma base muito forte pode doar diretamente íons oh- Não há necessidade de reagir com água; Como com o Naoh.
Lewis
Finalmente, os ácidos de Lewis são aqueles que ganham ou aceitam elétrons, e as bases de Lewis são aquelas que doam ou perdem elétrons.
Por exemplo, a base do NH Bronsted-Lowry3 É também uma base de Lewis, já que o átomo de nitrogênio aceita um h+ Ao doar este par de elétrons livres (h3N: h+). É por isso que as três definições não discordam entre si, mas elas se entrelaçam e ajudam a estudar acidez e basicidade em um espectro mais amplo de compostos químicos.
Pode atendê -lo: níquel: história, propriedades, estrutura, usos, riscosExemplos de ácidos
Tendo esclarecido as definições, uma série de ácidos será mencionada abaixo com suas respectivas fórmulas e nomes:
-HF: ácido fluorífrico
-HBR: ácido bromidrico
-Oi: ácido yodhydric
-H2S: ácido sulfidrico
-H2SE: ácido seleenenhdric
-H2TE: Ácido telurífrico
Estes são ácidos binários, também chamados hidraceids, que pertencem ao ácido clorídrico mencionado acima, HCl, HCl.
-Hno3: Ácido nítrico
-Hno2: Ácido nitroso
-HNO: ácido hiponitroso
-H2Co3: Ácido carbónico
-H2Co2: carbonoso ácido, que é realmente conhecido mais pelo nome do ácido fórmico, hcooh, o ácido orgânico mais simples de todos
-H3Po4: ácido fosfórico
-H3Po3 ou h2[HPO3]: ácido fosforoso, com uma ligação H-P
-H3Po2 ou h [h2Po2]: ácido hipofosférico, com duas ligações H-P
-H2SW4: ácido sulfúrico
-H2SW3: Ácido sulfuroso
-H2S2QUALQUER7: ácido dissulfúrico
-Hio4: ácido periódico
-Hio3: Ácido yodium
-Hio2: iodose ácido
-HIO: Hycoyodoso ácido
-H2Cro4: ácido crômico
-Hmno4: Ácido mangânico
-CH3COOH: ácido acético (vinagre)
-CH3SW3H: Ácido metanossulfônico
Todos esses ácidos, exceto o fórmico e os dois últimos, são conhecidos como oxácidos ou ácidos ternários.
Outros:
-Alcl3: cloreto de alumínio
-FECL3: cloreto férrico
-BF3: Boro Trifluoruro
-Cátions metálicos dissolvidos em água
-Carbocações
-H (ChbonzeClonze): Super ácido carborano
- Fso3H: Ácido fluorossulfônico
- HSBF6: Ácido fluoroantimônico
- Fso3H · SBF5: Ácido mágico
Os últimos quatro exemplos compõem os super ácidos temíveis; compostos capazes de se desintegrar quase qualquer material com quase tocando. O alcl3 É um exemplo de ácido de Lewis, uma vez que o centro de metal de alumínio é capaz de aceitar elétrons devido à sua deficiência eletrônica (não completa seu octeto de Valência).
Pode atendê -lo: Hidróxido de Mercúrio: Estrutura, Propriedades, Usos, RiscosExemplos de bases
Entre as bases inorgânicas, temos hidróxidos de metal, como hidróxido de sódio, e algumas hidurnas moleculares, como a amônia já citada. Aqui estão outros exemplos de bases:
-KOH: hidróxido de potássio
-Lioh: hidróxido de lítio
-RBOH: hidróxido de rubidio
-CSOH: hidróxido de césio
-Froh: hidróxido de Frania
-Seja (oh)2: hidróxido de Beryl
-Mg (oh)2: hidróxido de magnésio
-CA (OH)2: hidróxido de cálcio
-SR (OH)2: Hidróxido de estrôncio
-Ba (oh)2: hidróxido de bário
-Ra (oh)2: hidróxido de rádio
-Fé (oh)2: hidróxido ferroso
-Fé (oh)3: hidróxido férrico
-Al (oh)3: hidróxido de alumínio
-PB (OH)4: Hidróxido plúmbico
-Zn (OH)2: hidróxido de zinco
-CD (OH)2: hidróxido de cádmio
-Cu (Oh)2: Hidróxido cúprico
-Ti (oh)4: hidróxido Titanic
-Ph3: fosfina
-Cinzas3: Arsina
-NANH2: sódio Amiduro
- C5H5N: Piridina
-(CH3) N: trimetilamina
- C6H5NH2: Fenilamina ou anilina
-Nah: hidreto de sódio
-KH: hidreto de potássio
-Carbanions
-Li3N: nitreto de lítio
-Alcoxidado
-[(CH3)2CH]2NLI: diisopropilamida de lítio
-Ânion dietinilbenzeno: c6H4C42- (a base mais forte conhecida até agora)
Referências
- Whitten, Davis, Peck e Stanley. (2008). Química. (8ª ed.). Cengage Learning.
- Shiver & Atkins. (2008). Química Inorgânica. (Quarta edição). Mc Graw Hill.
- Naomi Hennah. (10 de outubro de 2018). Como ensinar ácidos, bases e sais. Recuperado de: edu.Rsc.org
- Helmestine, Anne Marie, Ph.D. (31 de agosto de 2019). Fórmulas de ácidos e bases comuns. Recuperado de: pensamento.com
- David Wood. (2019). Comparar ácidos e bases comuns. Estudar. Recuperado de: estudo.com
- Ross Pomeroy. (23 de agosto de 2013). Os ácidos mais fortes do mundo: como fogo e gelo. Recuperado de: RealClearscience.com
- Wikipedia. (2019). Dianion dietinylbenzeno. Recuperado de: em.Wikipedia.org
- « Símbolos e fórmulas de diâmetro, como retirá -lo, circunferência
- Ecofisiologia que estudos e aplicações em animais e vegetais »

