Yoduro, mas características, estrutura, funções
- 2483
- 575
- Terrence King IV
O Yoduro peroxidase ou a peroxidase da tireóide (TPO) é uma hemo-glicoproteína pertencente à família de peroxidases de mamíferos (como mieloperoxidase, lactoperoxidase e outros) que participam da rota de síntese do hormônio da tireóide.
Sua principal função é a de "iodinação" do desperdício de tirosina na tioglobulina e a formação da 3-3'-5-triiiodotironina (T3) e da tiroxina (T4) através de uma reação de "acoplamento" intramolecular de tirosinas iodizadas.
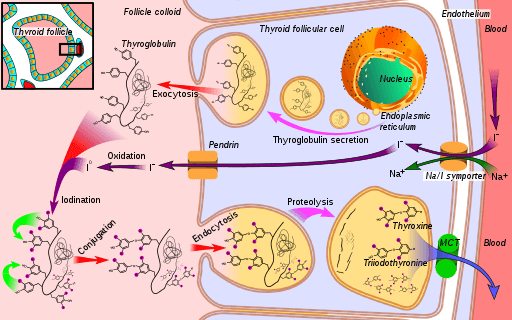
 Esquema da via biossintética do hormônio da tireóide, onde a iodeto peroxidase (na oxidação do iodeto em iodo) (fonte: Mikael Häggström [cc0] via Wikimedia Commons)
Esquema da via biossintética do hormônio da tireóide, onde a iodeto peroxidase (na oxidação do iodeto em iodo) (fonte: Mikael Häggström [cc0] via Wikimedia Commons) Triiodonina e tiroxina são dois hormônios produzidos pela glândula tireóide que têm funções essenciais em desenvolvimento, diferenciação e metabolismo dos mamíferos. Seu mecanismo de ação depende da interação de seus receptores nucleares com sequências genéticas específicas de seus genes brancos.
A existência da enzima yoduro peroxidase foi confirmada na década de 1960 por diferentes autores e atualmente foram feitos avanços consideráveis em relação à determinação de sua estrutura, suas funções e as características do gene que a codifica em diferentes organismos.
Em grande parte da literatura relacionada a esta enzima, isso é conhecido como "autoantígeno" microssomal e está relacionado a algumas doenças auto -imunes da tireóide.
Graças às suas características imunogênicas, esta enzima é uma molécula branca ou alvo.
[TOC]
Caracteristicas
O iodeto de peroxidase é codificado por um gene localizado no cromossomo 2 de humanos, que mede mais de 150 kpb e é composto por 17 exons e 16 íntrons.
Esta proteína transmembranal, com um único segmento imerso na membrana, está intimamente relacionado à mieloperoxidase, com quem compartilha mais de 40% da similaridade da sequência de aminoácidos.
Pode servir a você: acilglicerídeos: características, estrutura, tipos, funçõesSua síntese ocorre nos polirribossomos (conjunto de ribossomos responsáveis pela tradução da mesma proteína) e é então inserida na membrana do retículo endoplasmático, onde passa por um processo de glicosilação.
Uma vez sintetizada e glicosilada, o iodeto de peroxidase é transportado para o pólo apical da atração (células da tireóide ou células da tireóide), onde é capaz de expor seu centro catalítico em direção ao lúmen folicular da tireóide.
Regulação da expressão
A expressão do gene de codificação da tireóide ou iodeto peroxidase é controlada por fatores específicos de transcrição da tireóide, como TTF-1, TTF-2 e Pax-8.
Os elementos genéticos que permitem aumentar ou aprimorar a expressão desse gene em humanos foram descritos nas regiões que flanqueiam o final 5 'do mesmo, geralmente entre os 140 pares de 140 bases desta região "Flanqueante".
Existem também elementos que reprimem ou diminuem a expressão dessa proteína, mas, diferentemente dos "potenciadores", estes foram descritos a jusante da sequência do gene.
Grande parte da regulação da expressão genética da iodeto peroxidase ocorre de maneira específica do tecido, e isso depende da ação dos elementos da união de DNA que agem em Cis, como fatores de transcrição TTF-1 e outros.
Estrutura
Esta proteína com atividade enzimática possui cerca de 933 resíduos de aminoácidos e um extremo C-terminal extracelular de 197 aminoácidos provenientes da expressão de outros módulos de genes que codificam para outras glicoproteínas.
Seu peso molecular é de cerca de 110 kDa e faz parte do grupo de proteínas transmembranosas glicosiladas do tipo 1, uma vez que possui um segmento transmembranal glicosilado e um grupo Hemo em seu local ativo ativo.
Pode servir a você: glândulas: tipos, função, inflamação e doençasA estrutura desta proteína tem, pelo menos, uma ponte dissulfeto na região extracelular que forma um loop fechado característico que é exposto na superfície dos tirócitos.
Funções
A principal função fisiológica do iodeto de peroxidase está relacionada à sua participação na síntese do hormônio da tireóide, onde catalisa a “iodação” do desperdício de tirosina de monoyodotirosina (MIT) e diousyrosina (DIT), além do acoplamento da iodirosina Resíduos em tioglobulina.
Qual é a síntese do hormônio da tireóide?
Para entender a função da enzima peroxidase da tireóide, é necessário considerar as etapas da síntese hormonal onde participa:
1 sitilidade com o transporte de iodeto para a tireóide e continua com
2-A geração de um agente oxidante, como peróxido de hidrogênio (H2O2)
3 posteriormente uma proteína receptora é sintetizada, tioglobulina
4-yoduro é oxidado em um estado de Valencia mais antigo e depois
5-yoduro é unido ao resíduo de tirosina presente na tioglobulina
A tioglobulina de 6 em 6 em
7--a tioglobulina é armazenada e cuspida, então
8--iodirosinas iodirosinas são removidas e finalmente,
9-tiroxina é liberada e triiodotyron em direção ao sangue; Esses hormônios exercem seus efeitos por interação com seus receptores específicos, localizados na membrana nuclear e são capazes de interagir com sequências de DNA branco, funcionando como fatores de transcrição.
Como poderia ser destacado do conhecimento das funções dos dois hormônios cuja síntese participa (T3 e T4), o iodeto de peroxidase tem implicações importantes no nível fisiológico.
A falta de ambos os hormônios durante o desenvolvimento humano produz defeitos no crescimento e retardo mental, bem como desequilíbrios metabólicos na vida adulta.
Pode atendê -lo: holoenzyme: características, funções e exemplosDoenças relacionadas
O iodeto de peroxidase é um dos principais autoantígenos da tireóide em humanos e está relacionado à citotoxicidade mediada pelo sistema de complemento. Sua função como autoantígeno se destaca em pacientes com doenças autoimunes da tireóide.
A doença de gota, por exemplo, se deve a uma deficiência de conteúdo de iodo durante a síntese hormonal na tireóide, que tem sido associada a um produto de deficiência de iodinação por tireoglobulina de certos defeitos em certos defeitos na peroxidase peroxidase.
Alguns carcinomas são caracterizados por ter funções alteradas de iodeto de peroxidase, ou seja, os níveis de atividade dessa enzima são significativamente menores do que em pacientes não -câncer.
No entanto, estudos confirmaram que é uma característica extremamente variável, que depende não apenas do paciente, mas do tipo de câncer e das regiões afetadas.
Referências
- Degroot, l. J., & Niepomniszcze, h. (1977). Biossíntese do hormônio da tireóide: aspectos básicos e clínicos. Progresso na endocrinologia e metabolismo, 26(6), 665-718.
- FRATU, p., & Nataf, b. M. (1976). Atividade de peroxidase da tireóide humana em distúrbios benignos e malignos da tireóide. A sociedade endócrina, Quatro cinco(5), 1089-1096.
- Kimura, s., & Ikeda-saito, M. (1988). Myeloperoxidae e tireoide peroxidase humana, duas enzimas com funções fisiológicas separadas e distintas, são membros relacionados à evolução da mesma família de genes genes. Proteínas: estrutura, função e bioinformática, 3, 113-120.
- Nagasaka, a., Hidaka, h., & Ishizuki, e. (1975). Estudos sobre iodeto humano peroxidase: sua atividade em vários distúrbios da tireóide. Lei Química Clínica, 62, 1-4.
- RUF, J., & Carayon, P. (2006). Aspectos estruturais e funcionais da peroxidase da tireóide. Arquivos de Bioquímica e Biofísica, 445, 269-277.
- RUF, J., Toubert, m., Czarnocka, b., Durand-Gorde, m., Ferrand, m., & Carayon, P. (2015). Relação entre estrutura imunológica e propriedades bioquímicas da peroxidase da tireóide humana. Revisões endócrinas, 125(3), 1211-1218.
- Taurog, a. (1999). Evolução molecular da peroxidase da tireóide. Biochimie, 81, 557-562.
- Zhang, j., & Lazar, M. PARA. (2000). O mecanismo de ação dos hormônios da tireóide. Annu. Rev. Physiol., 62(1), 439-466.
- « Operação enzimática e exemplos
- Revolução boliviana de 1952 Causas, características, consequências »

