Óxidos não -metálicos

- 3137
- 134
- Tim Mann
 O dióxido de carbono é um gás de efeito estufa e também é um óxido não metálico
O dióxido de carbono é um gás de efeito estufa e também é um óxido não metálico O que são óxidos não metálicos?
O óxidos não -metálicos São compostos binários formados entre um não -metal com estado de oxidação positivo e oxigênio com o estado de oxidação -2. Também chamado anidrides e óxidos ácidos, esses compostos tendem a formar soluções ácidas, dissolvendo -os na água e também tendem a reagir com óxidos básicos para formar sais oxisais.
Óxidos não metálicos são de natureza muito comum. Na verdade, eles estão por toda parte. A água, o líquido vital que cobre dois terços da superfície da Terra, é um óxido não -metálico. O mesmo acontece com o dióxido de carbono que exalamos durante nossos óxidos de respiração e enxofre que contaminam o ar e que causam chuva ácida.
Sendo formado por não -metais e oxigênio (que também é não -metal), os links que unem seus átomos são ligações covalentes, na maioria dos casos polares. Por esse motivo, a grande maioria dos óxidos não -metálicos ou de anidrides tem pontos de ebulição consideravelmente baixos, e muitos deles são gases à temperatura ambiente.
Propriedades de óxidos não metálicos
- Eles não têm brilho de brilho ou brilho metálico.
- Eles podem ter cores diferentes.
- Seus átomos estão unidos por meio de ligações covalentes em vez de links iônicos.
- Eles são formados por oxigênio e um não -metal.
- Comparados aos óxidos metálicos, eles geralmente têm baixos pontos de fusão e ebulição, embora muito diversificados.
- A maioria é gases, mas também pode ser encontrada em estado sólido (como n2QUALQUER3) ou líquido à temperatura ambiente.
- Os óxidos não -metálicos sólidos geralmente são quebradiços e podem ter dureza diferente.
- Eles são maus condutores de calor e eletricidade.
- Ao dissolvê -los na água, eles reagem para formar ácidos oxácidos.
- Alguns de seus ácidos oxácidos são ácidos fortes que tendem a formar ânions ou oxianiões em solução aquosa.
- Eles reagem com óxidos básicos para formar sais oxisais.
Tipos de óxidos não metálicos
Não há classificação formal ou universalmente aceita de óxidos não metálicos. No entanto, estes podem ser agrupados de acordo com suas propriedades ácidas-base.
Embora os óxidos não -metálicos também sejam chamados de óxidos ácidos, nem todos eles sempre reagem como ácidos contra outros compostos. Em vista disso, três tipos diferentes de óxidos não metálicos podem ser identificados de acordo com suas propriedades de ácido/base:
Óxidos de ácido não metálico
Eles são os mais comuns. A grande maioria dos compostos entre oxigênio e outro não -metal, independentemente de seu status de oxidação, produz ácidos minerais ao dissolvê -los na água, dando origem a soluções ácidas.
- Alguns exemplos de óxidos ácidos são anidridos nítricos (n2QUALQUER5) e o anidrido sulfúrico (então3).
Óxidos não -metálicos neutros
Alguns óxidos não -metálicos não reagem com água quando se dissolvem. Nesses casos, a solução resultante é neutra (não é ácida nem básica).
- Alguns exemplos de óxidos neutros são monóxido de carbono (CO), óxido nitroso (N₂O) e dióxido de cloro (CLO2).
Óxidos anfóticos não metálicos
O fim Anfótero Refere -se à capacidade de um composto químico se comportar como ácido ou base, dependendo de quem reage a. Isto é, esses são compostos que são ácidos e bases ao mesmo tempo.
- Entre os óxidos anfóticos não -metálicos, o mais comum é a água (H2QUALQUER). A água é anfotente, pois é capaz de dar um próton a uma base (agindo como ácido), mas também é capaz de receber um próton de um ácido (agindo como base).
Exemplos de óxidos não metálicos
Os óxidos não -metálicos mais comuns de cada não -metal são apresentados abaixo, juntamente com sua fórmula molecular, seu nome de acordo com a nomenclatura sistemática do IUPAC, de acordo com a nomenclatura das ações e de acordo com a nomenclatura tradicional:
Óxidos de carbono
Fórmula | Nome sistemático da IUPAC | Nomenclatura de ações | Nome tradicional |
Co | Monóxido de carbono | Óxido de carbono (II) | Anidrido carbonoso |
CO2 | Dióxido de carbono | Óxido de carbono (IV) | Anidrido carbônico |
Óxidos de nitrogênio
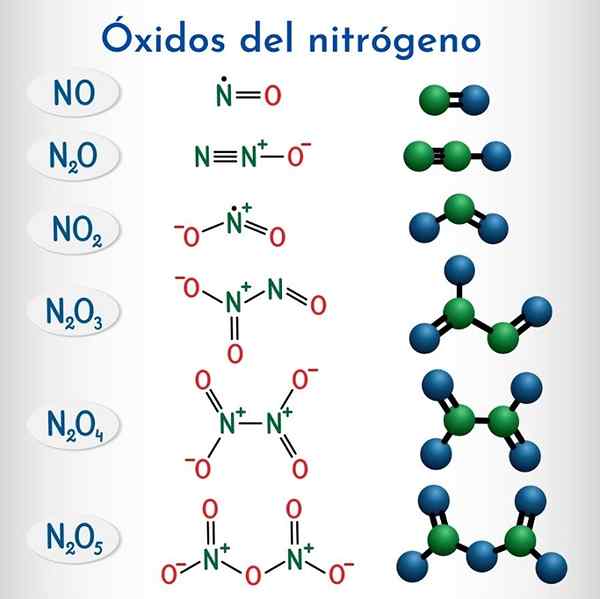 Fórmulas e estruturas dos 6 óxidos de nitrogênio não metálicos
Fórmulas e estruturas dos 6 óxidos de nitrogênio não metálicos Fórmula | Nome sistemático da IUPAC | Nomenclatura de ações | Nome tradicional |
N2O | Monóxido de dinitrogênio | Óxido de nitrogênio (i) | Óxido nitroso (Hiposonitroso anhydride) |
NÃO | Monóxido de nitrogênio | Óxido de nitrogênio (II) | Óxido nítrico |
N2O3 | Trioxido de dinitrogênio | Óxido de nitrogênio (III) | Anidrido nitroso |
N2O4 | Tetraxido de dinitrogênio | Óxido de nitrogênio (IV) | Tetraxido de nitrogênio |
NO2 | Dióxido de nitrogênio | Óxido de nitrogênio (IV) | Dióxido de nitrogênio |
N2O5 | Pentaxido de dinitrogênio | Óxido de nitrogênio (V) | Anidrido nítrico |
Óxidos de fósforo
Fórmula | Nome sistemático da IUPAC | Nomenclatura de ações | Nome tradicional |
P2O3 | Trióxido de difusão | Óxido de fósforo (III) | Anidrido de fósforo |
P2O5 | Pentaxido difosfaco | Óxido de fósforo (V) | Anidrido fosfórico |
P2O4 | Tetraxido difosfaco | Óxido de fósforo (III, V) | --- |
Óxidos de arsênico
Fórmula | Nome sistemático da IUPAC | Nomenclatura de ações | Nome tradicional |
AS2O3 | Trioxido diarsênico | Óxido de arsênico (III) | Arsenioso anhidrido |
AS2O5 | Pentaxido diarsênico | Óxido de arsênico (V) | Anidrido de arsênico |
Óxidos antimônicos
Fórmula | Nome sistemático da IUPAC | Nomenclatura de ações | Nome tradicional |
SB2O3 | Trioxido Diantimony | Óxido antimônio (III) | Anidrido antimonioso |
SB2O5 | Pentaxido de Diantimony | Óxido antimônio (V) | Anidrido antimônico |
Óxidos de enxofre
Fórmula | Nome sistemático da IUPAC | Nomenclatura de ações | Nome tradicional |
SW | Monóxido de enxofre | Óxido de enxofre (II) | Anidrido hipossulfuroso |
SO2 | Dióxido de enxofre | Óxido de enxofre (IV) | Anidrido de enxofre |
SO3 | Trióxido de enxofre | Óxido de enxofre (VI) | Anidrido sulfúrico |
Óxidos de selênio
Fórmula | Nome sistemático da IUPAC | Nomenclatura de ações | Nome tradicional |
SEO | Monóxido de selênio | Óxido de selênio (II) | Anidrido hipiplolenoso |
SEO2 | Dióxido de selênio | Óxido de selênio (IV) | Anidrido selenário |
SEO3 | Trióxido de selênio | Óxido de selênio (VI) | Selénic anidrido |
Telurio Oxides
Fórmula | Nome sistemático da IUPAC | Nomenclatura de ações | Nome tradicional |
Teo | Monóxido de telurio | Telurio Oxide (II) | Anidrido hipelimável |
TEO2 | Dióxido de telurio | Telurio Oxide (IV) | Anidrido teluroso |
TEO3 | Trióxido Telurio | Telurio Oxide (VI) | Anidrido telúrico |
Óxidos de cloro
Fórmula | Nome sistemático da IUPAC | Nomenclatura de ações | Nome tradicional |
CL2O | Monóxido de cloro | Óxido de cloro (i) | Anidrido hipocloroso |
CL2O3 | Trióxido de cloro | Óxido de cloro (iii) | ANIDRIDO DE CLORO |
CL2O5 | Pentaxido de cloro | Óxido de cloro (V) | Anidrido clorico |
CL2O7 | Heptoxido de cloro | Óxido de cloro (vii) | Anidrido perclórico |
Óxidos de bromo
Fórmula | Nome sistemático da IUPAC | Nomenclatura de ações | Nome tradicional |
BR2O | Monóxido de bromo | Óxido de bromo (i) | Hipobromous anidrido |
BR2O3 | Trióxido de bromo | Óxido de bromo (iii) | Bromo anidrido |
BR2O5 | Pentaxido de bromo | Óxido de bromo (V) | Anidrido brômico |
BR2O7 | Bromine heptaoxide | Óxido de bromo (vii) | Anidrido perbrômico |
Óxidos de iodo
Fórmula | Nome sistemático da IUPAC | Nomenclatura de ações | Nome tradicional |
I2o | Monóxido de iodo | Óxido de iodo (i) | Hipoyodoso anidrido |
I2o3 | Trióxido de iodo | Óxido de iodo (III) | Yodoso anidrido |
I2o5 | Pentaxido de iodo | Óxido de iodo (V) | Yodium anidrido |
I2o7 | Heptoxido de iodo | Óxido de iodo (vii) | Anidrido periadicóico |

