Óxidos básicos

- 3932
- 871
- Gilbert Franecki
Explicamos quais são os óxidos básicos, como suas propriedades, nomenclatura e damos vários exemplos são formados,
 Muitos óxidos básicos têm impressionante, característica das cores de metal
Muitos óxidos básicos têm impressionante, característica das cores de metal O que são óxidos básicos?
O óxidos básicos Eles são compostos inorgânicos formados pela união entre oxigênio e um metal. Eles são chamados de óxidos básicos porque produzem soluções alcalinas ou básicas ao se dissolver na água. Também porque eles reagem com ácidos para formar um sal e água através de uma reação de neutralização ácida-base.
Óxidos básicos são muito comuns. De fato, a maioria dos metais na natureza é encontrada em solos de óxidos, então eles costumavam ser chamados de terra.
Os óxidos básicos são de grande importância para a indústria. Muitos pigmentos coloridos usados na indústria são óxidos. Outros óxidos são usados como base para pinturas, especialmente titânio, líder e óxidos de zinco.
Propriedades dos óxidos básicos
Eles são compostos binários
Esses compostos são formados apenas por dois elementos: oxigênio e um metal. Portanto, eles são compostos binários.
Sua fórmula empírica é M2QUALQUERX ou MOX/2
A valência do oxigênio nos óxidos é sempre -2, de modo que as fórmulas empíricas dos óxidos são simplificadas quando a valência de metal é um número de torque. No entanto, o mesmo não acontece quando é estranho.
Por exemplo, a fórmula empírica de óxido de sódio é na na2Ou porque o sódio tem valência +1 (ímpar). Em vez disso, a fórmula empírica de óxido de cálcio é CAO, pois o cálcio tem Valência +2.
Eles são compostos inorgânicos, quase sempre iônicos
A maioria dos óxidos básicos são compostos iônicos cristalinos. Isso inclui os óxidos de todos os metais alcalinos, de todos os alcalinos (exceto o berílio) e a primeira série de metais de transição.
Pode atendê -lo: vínculo químicoEles têm pontos de ebulição e de ebulição muito altos
O vínculo iônico mantém todos os íons que formam óxidos básicos fortemente unidos. Isso os torna difíceis de derreter e ainda mais difíceis de vaporizar. Por esse motivo, eles têm pontos de ebulição muito altos e de ebulição.
Eles são sólidos à temperatura ambiente
Devido ao mesmo fato de ter pontos altos de fusão, todos os óxidos básicos são sólidos à temperatura ambiente.
Eles são compostos básicos
A razão pela qual eles são chamados de óxidos básicos é precisamente por causa de suas propriedades ácidas-base. Óxidos com maior caráter iônico produzem soluções básicas ao se dissolver na água e também reagem com ácidos, neutralizando -os.
No entanto, deve -se notar que nem todos os óxidos metálicos são básicos. Alguns são neutros, outros ácidos e outros anfotores.
A maioria é pouco solúvel ou insolúvel na água
Todos os óxidos básicos são insolúveis em água, com exceção dos óxidos de metais alcalinos e de bário. No entanto, eles são solúveis em soluções ácidas.
Como são óxidos básicos?
Óxidos básicos podem ser formados espontaneamente quando os metais são expostos ao oxigênio do ar. De fato, camadas de corrosão formadas na superfície dos metais consistem em diferentes óxidos básicos.
O metal envolvido, em geral, é um alcalino, metal alcalino ou metal de transição.
Você pode escrever três reações gerais para a formação de óxidos, dependendo de o Valencia de metal ser par ou estranho:
Para metais com valências estranhas:
Quando o metal tem valência estranha, a reação geral da formação de óxido é:

Por exemplo, para a formação de óxido de sódio, onde o sódio tem Valência +1, a reação é:
Pode atendê -lo: fósforo: história, propriedades, estrutura, obtenção, uso
Outro exemplo é a formação de óxido férrico, no qual o ferro tem oxidação ou valência +3. Nesse caso, a reação é:

Para metais com Valencia +2:
Quando o metal tem Valência +2, a reação geral da formação de óxido é:

Por exemplo, no caso de formação de óxido de cálcio, onde o cálcio tem Valência +2, a reação é:

Para metais com outros pares:
Quando o metal tem valências até +2, a reação geral da formação de óxido é:
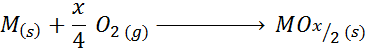
Um exemplo deste caso é a reação de formação de óxido de titânio (iv):

Oxídios básicos Nomenclatura
Existem três sistemas de nomenclatura para os óxidos básicos que são: a nomenclatura tradicional, o estoque e o sistema sistemático.
Para nomear um óxido de acordo com os dois primeiros sistemas de nomenclatura, é necessário conhecer o Metal Valencia, enquanto para o último.
Nomenclatura tradicional
De acordo com a nomenclatura tradicional, os óxidos básicos são nomeados começando com a palavra qualquerXido seguido pelo nome do cátion. Este sobrenome é construído colocando a raiz do nome de metal e um sistema de prefixos e sufixos indicado pelo Metal Valencia:
Óxido + Prefixo-raí-sufijo
As regras para atribuir prefixos e sufixos estão resumidas na tabela a seguir:
Número de valências possíveis | Valencia | Prefixo | Sufixo |
1 Valencia única | |||
Apenas | --- | ___ico | |
2 Valenciais | |||
Idoso | --- | ___ico | |
Menor | --- | ___urso | |
3 valências | |||
Idoso | --- | ___ico | |
Intermediário | --- | ___urso | |
Menor | Soluço___ | ___urso | |
4 valências | |||
Idoso | Por___ | ___ico | |
Principal intermediário | --- | ___ico | |
Intermediário menor | --- | ___ico | |
Menor | Soluço___ | ___ico |
Exemplo:
Ele Fé2QUALQUER3 É um óxido de ferro com valência +3. O ferro tem apenas duas valores que são +2 e +3, portanto, neste óxido, o ferro tem o mais antigo de duas vales. Por esse motivo, o sufixo é adicionado ___ico na raiz do nome do metal de ferro que é Ferr-.
Pode atendê -lo: sem eletrólitos: características e exemplosPortanto, o nome tradicional de Fé2QUALQUER3 é: Óxido férrico.
Nomenclatura de ações
Neste sistema, o nome é construído começando com as palavras óxido de, seguido de nome de metal. Finalmente, sua Valência é colocada em números romanos entre parênteses:
Metal + Nome Oxide (Valência)
Caso o metal tenha apenas uma valência, é omitido.
Exemplo:
Em cr2QUALQUER3 O cromo tem valência +3, então o estoque de nome é Óxido cromo (III).
Nomenclatura sistemática
Esta é a única das três nomenclaturas que não especificam a Valencia de metal. Os nomes sitemáticos indicam quantos átomos de oxigênio e metal contêm o composto usando prefixos numéricos.
O nome é construído com a palavra óxido precedido por ele prefixo indicando o número de oxigênio, Então o artigo de seguido pela Nome de metal com seu respectivo prefixo.
Prefixo-óxido + de + prefixo-metal
Alguns prefixos são:
Número | Prefixo |
1 | BUN |
2 | Deu |
3 | Tri |
4 | Tetra |
5 | Penta .. |
Exemplo:
Na nomenclatura sistemática, o CR2QUALQUER3 É chamado de trióxido de Dichroma, pois possui três oxigênio e dois cromos.
Exemplos de óxidos básicos
- Óxido de sódio - Na2QUALQUER
- Óxido férrico - fé2QUALQUER3
- Monóxido de ferro - feio
- Óxido crômico - CR2QUALQUER3
- Divanadio pentaxido - V2QUALQUER5
- Óxido de potássio - K2QUALQUER
- Óxido de bário - bao

