Estrutura de óxido de estanho (ii), propriedades, nomenclatura, usa

- 4307
- 1039
- Mr. Reginald Lindgren
Ele Óxido de lata (II) É um sólido inorgânico cristalino que é formado pela oxidação de estanho (sn) por oxigênio, onde o estanho adquire Valencia 2+. Sua fórmula química é sno. Duas maneiras diferentes deste composto são conhecidas: o preto e o vermelho. A forma comum e mais estável à temperatura ambiente é a modificação preta ou preta-azul.
Este formulário é preparado por hidrólise de cloreto de estanho (ii) (SNCl2) Em solução aquosa, à qual é adicionado hidróxido de amônio (NH4Oh) para obter um óxido hidratado precipitado de sn (ii) cuja fórmula é sno.Xh2Ou, onde x<1 (x menor que 1).
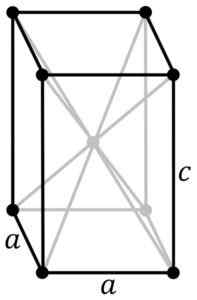 Estrutura cristalina tetragonal do sno-azul preto. O átomo de SN está localizado no centro da estrutura e átomos de oxigênio nos vértices do paralelepiped. PNGs originais por usuário: Rocha, rastreado em Inkscape pelo usuário: Stannered [CC BY-SA 3.0 (http: // criativecommons.Org/licenças/BY-SA/3.0/]] Fonte: Wikipedia Commons
Estrutura cristalina tetragonal do sno-azul preto. O átomo de SN está localizado no centro da estrutura e átomos de oxigênio nos vértices do paralelepiped. PNGs originais por usuário: Rocha, rastreado em Inkscape pelo usuário: Stannered [CC BY-SA 3.0 (http: // criativecommons.Org/licenças/BY-SA/3.0/]] Fonte: Wikipedia Commons O óxido hidratado é um sólido amorfo branco, que é aquecido em suspensão a 60-70 ºC por várias horas na presença de NH4Oh, até você pegar o preto cristalino puro sno.
A forma vermelha do SNO é metaestável. Pode ser preparado adicionando ácido fosfórico (h3Po4) - com 22% de ácido fosfora, h3Po3 - E então NH4Oh uma solução SNCl2. O sólido branco obtido é aquecido na mesma solução para 90-100 ºC por cerca de 10 minutos. Dessa maneira, o Sno cristalino vermelho puro é obtido.
O óxido de lata (II) é um material de partida para a produção de outros compostos de lata (ii). Por esse motivo, é um dos compostos de lata que tem uma importância comercial apreciável.
O óxido de lata (II) apresenta baixa toxicidade como na maioria dos compostos inorgânicos de estanho. Isso se deve à sua baixa absorção e à rápida excreção de tecidos dos seres vivos.
Pode servir a você: Bipe Beraral: O que é, características, para que éApresenta uma das maiores tolerâncias de compostos de lata nos testes realizados com ratos. No entanto, pode ser prejudicial se for inalado em grandes quantidades.
[TOC]
Estrutura
Óxido de lata (ii) Black-azul
Esta modificação cristaliza com estrutura tetragonal. Tem uma camada organizando.
Outros pesquisadores afirmam que cada átomo de SN é cercado por 5 átomos de oxigênio que estão aproximadamente nos vértices de um octaedro, onde o sexto vértice é presumivelmente ocupado por um par de elétrons grátis ou não emparelhados. Isso é conhecido como arranjo Ócticos.
Óxido de lata vermelha (II)
Esta forma de óxido de lata (ii) cristaliza com estrutura ortorrômbica.
Nomenclatura
- Óxido de lata (II)
- Estany óxido
- Monóxido de lata
- Estany óxido
Propriedades
Estado físico
Sólido cristalino.
Peso molecular
134,71 g/mol.
Ponto de fusão
1080 ºC. Se decompõe.
Densidade
6,45 g/cm3
Solubilidade
Insolúvel em água fria ou quente. Insolúvel em metanol, mas se dissolve rapidamente em ácidos e alcalis concentrados.
Outras propriedades
Se mais de 300 ºC for aquecida na presença de ar, o óxido de lata (II) é rapidamente oxidado no óxido de estanho (iv) que apresenta incandescência.
Foi relatado que, sob condições não oxidantes, o aquecimento de óxido de estanho (ii) tem vários resultados de acordo com o grau de pureza do óxido inicial. Geralmente é desproporcional no SN metálico e óxido de estanho (IV), SNO2, Com várias espécies intermediárias que finalmente se tornam sno2.
O óxido de lata (II) é o Amfotero, pois é dissolvido em ácidos para dar íons Sn2+ ou complexos de ânions, e também se dissolve em álcalis para formar soluções de íons hidroxi-stanning, SN (OH)3-, que têm uma estrutura piramidal.
Pode servir a você: ácido perclórico: fórmula, características e usosAlém disso, o SNO é um agente redutor e reage rapidamente com ácidos orgânicos e minerais.
Apresenta baixa toxicidade se comparado a outros sais de lata. Sua DL50 (dose letal de 50% ou dose letal média) em ratos é superior a 10000 mg/kg. Isso significa que mais de 10 gramas por quilograma são necessários para matar 50% das amostras de ratos em um determinado período de teste. Em comparação, o fluoreto de estanho (ii) apresenta um dl50 de 188 mg/kg.
No entanto, se for inalado por um longo tempo, é depositado nos pulmões porque não é absorvido e pode produzir estanho (infiltração do pó Sno nos interstícios pulmonares).
Formulários
Na produção de outros compostos de lata (ii)
Sua rápida reação com ácidos é a base de seu uso mais importante, que é como intermediário na fabricação de outros compostos de lata.
É usado na produção de brometo de lata (II) (SNBR2), Cianeto de lata (II) (SN (CN)2) e hidrato de fluoroborato de lata (II) (SN (BF4)2), Entre outros compostos de lata (ii).
O fluoroborato de lata (II) é preparado dissolvendo a snam. Isso se deve, entre outras coisas, à sua alta capacidade de cobertura.
O óxido de estanho (ii) também é usado na preparação do sulfato de estanho (ii) (SNSO4), por reação de sno e ácido sulfúrico, h2SW4.
O SNSO4 Obtido, é usado no processo enlatado para a produção de placas de circuito impresso, para o acabamento de contato elétrico e para os utensílios de cozinha.
Pode atendê -lo: carbonato de alumínio: estrutura, propriedades, usos Circuito impresso. Nenhum autor legível por máquina fornecido. Abraham del Pozo assumiu (com base em reivindicações de direitos autorais). [Domínio Público] Fonte: Wikimedia Commons
Circuito impresso. Nenhum autor legível por máquina fornecido. Abraham del Pozo assumiu (com base em reivindicações de direitos autorais). [Domínio Público] Fonte: Wikimedia Commons A forma hidratada do sno, o hidrotado (ii) sno.Xh2Ou, é tratado com ácido fluorréricico para obter fluoreto de estanho (II), SNF2, que é adicionado aos cremes dentifricos como agente para combater a cárie.
Em jóias
O óxido de lata (II) é usado na preparação de cristais de estrech de ouro e estrios de cobre. Aparentemente, sua função neste aplicativo é atuar como um agente redutor.
 Jóia com rubi. Fonte: Pixabay
Jóia com rubi. Fonte: Pixabay Outros usos
Foi usado em dispositivos fotovoltaicos para a produção de eletricidade a partir da luz, como células solares.
 Dispositivo fotovoltaico. Georg Slickers [CC BY-SA 2.5 (https: // CreativeCommons.Org/licenças/BY-SA/2.5)] Fonte: Wikipedia Commons
Dispositivo fotovoltaico. Georg Slickers [CC BY-SA 2.5 (https: // CreativeCommons.Org/licenças/BY-SA/2.5)] Fonte: Wikipedia Commons Inovações recentes
Nanopartículas ordenadas por SNO foram usadas em eletrodos de nanotubos de carbono para baterias de açúcar de lítio.
 Nanofibras de hidrato de SNO. Fionán [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)] Fonte: Wikipedia Commons
Nanofibras de hidrato de SNO. Fionán [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)] Fonte: Wikipedia Commons Os eletrodos preparados de SNO exibem alta condutividade e pouca mudança de volume em ciclos repetitivos de carregamento e download.
Além disso, o SNO facilita uma transferência rápida de íons/elétrons durante as reações de redução de oxidação que ocorrem nesse sistema de bateria.
Referências
- Algodão, f. Albert e Wilkinson, Geoffrey. (1980). Química inorgânica avançada. Quarta edição. John Wiley & Sons.
- Dança, j.C.; Emeléus, h.J.; Sir Ronald Nyholm e Trotman-Deckenson, para.F. (1973). Química inorgânica abrangente. Volume 2. Pergamon Press.
- Enciclopédia de química industrial de Ullmann. (1990). QUINTA EDIÇÃO. Volume A27. Vch verlagsgellschaft mbh.
- Kirk-Othmer (1994). Enciclopédia de tecnologia química. Volume 24. Quarta edição. John Wiley & Sons.
- Ostrakhovitch, Elena para. E cherian, M. George. (2007). Lata. No Manual da Toxicologia dos Metais. Terceira edição. Recuperado de cientedirect.com.
- Kwestroo, w. e Vromans, P.H.G.M. (1967). Preparação de três modificações de óxido de estanho puro (ii). J. Inorg. Nucl. Chem., 1967, vol.29, pp.2187-2190.
- Foud, s.S et al. (1992). Propriedades ópticas de filmes finos de óxido estanoso. Revista de Física da Tchecoslováquia. Fevereiro de 1992, volume 42, edição 2. Recuperado de Springer.com.
- A-Young Kim et al. (2017). Nanopartículas SNO ordenadas no MWCNT como material de hospedeiro funcional para o cátodo de bateria de lítio-sulfur de alta taxa. Nano Research 2017, 10 (6). Recuperado de Springer.com.
- Biblioteca Nacional de Medicina. (2019). Óxido estanoso. Recuperado de: pubchem.NCBI.Nlm.NIH.Gov
- « História do tear de Jacquard, operação, usa
- História do funcionalismo (arquitetura), características, obras »

