Óxido de boro (B2O3) O que é, estrutura, propriedades, usa
- 1795
- 511
- Pete Wuckert
Ele óxido de boro o anidrido bórico é um composto inorgânico cuja fórmula química é B2QUALQUER3. Sendo os elementos de boro e oxigênio do bloco P da tabela periódica e ainda mais cabeças de seus respectivos grupos, a diferença na eletronegatividade entre eles não é muito alta; Portanto, espera -se que o B2QUALQUER3 ser de natureza covalente.
O b2QUALQUER3 É preparado dissolvendo o bórax no ácido sulfúrico concentrado dentro de uma fusão forno e a uma temperatura de 750ºC; Ácido bórico desidratando termicamente, B (OH)3, a uma temperatura de aproximadamente 300 ° C; ou também pode ser formado como um produto da reação diborano (b2H6) Com oxigênio.
O óxido de boro pode ter uma aparência semi -transparente ou de vidro cristalino; O último por moagem pode ser obtido em forma de poeira.
Embora não pareça a primeira vista, o B é considerado2QUALQUER3 como um dos óxidos inorgânicos mais complexos; Não apenas do ponto de vista estrutural, mas também devido às propriedades variáveis que o vidro e a cerâmica adquirem aos quais são adicionados à sua matriz.
Estrutura de óxido de boro
Unidade bo3
O b2QUALQUER3 É um sólido covalente, portanto, em teoria, eles não existem em sua estrutura de íons B3+ nem2-, Mas links B-O. Boron, de acordo com a teoria do Link de Valência (TEV), pode formar apenas três links covalentes; Nesse caso, três links B-O. Como conseqüência disso, a geometria esperada deve ser trigonal, bo3.
A molécula de BO3 São elétrons ruins, especialmente átomos de oxigênio; No entanto, vários deles podem interagir entre si para suprir a referida deficiência. Assim, os triângulos bo3 A eles se juntam compartilhando uma ponte de oxigênio e são distribuídos no espaço como redes triangulares de linhas com seus aviões orientados de diferentes maneiras.
Pode atendê -lo: solução insaturadaEstrutura cristalina
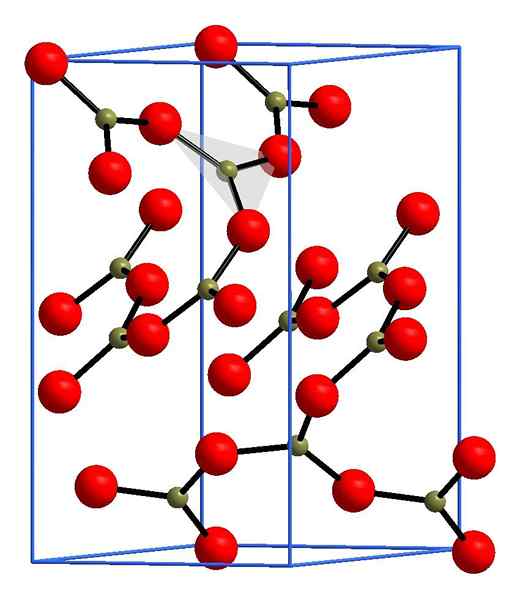
 Estrutura de óxido de boro. Andif1, Wikimedia Commons.
Estrutura de óxido de boro. Andif1, Wikimedia Commons. Na imagem superior, um exemplo dessas linhas com unidades triangulares bo3. Se for observado com cuidado, nem todos os rostos dos planos apontam para o leitor, mas para o outro lado. As orientações dessas faces podem ser responsáveis por como B é definido2QUALQUER3 a uma certa temperatura e pressão.
Quando essas redes têm um padrão estrutural longo, é um sólido cristalino, que pode ser construído a partir de sua célula unitária. É aqui que se diz que o B2QUALQUER3 Possui dois polimorfos cristalinos: α e β.
O α-B2QUALQUER3 É produzido em pressão ambiente (1 atm) e diz -se que é cinéticamente instável; De fato, essa é uma das razões pelas quais o óxido de boro é provavelmente um composto de cristalização difícil.
O outro polimorfo, β-b2QUALQUER3, Altas pressões são obtidas na faixa de GPA; Portanto, sua densidade deve ser maior que a de α-b2QUALQUER3.
Estrutura vítrea
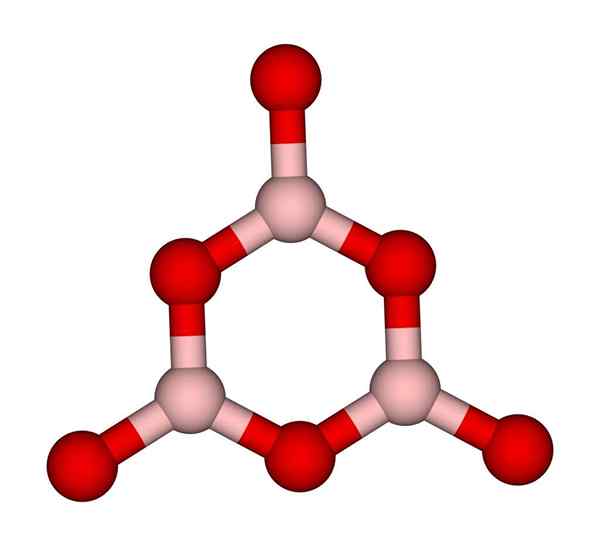 Anel de boroxol. Ccoil (conversa). Wikimedia Commons.
Anel de boroxol. Ccoil (conversa). Wikimedia Commons. Redes BO3 Naturalmente, tendem a adotar estruturas amorfas; São isso, que não possuem um padrão que descreva as moléculas ou íons no sólido. Sintetizando o B2QUALQUER3 Sua forma predominante é amorfa e não a cristalina; Em palavras corretas: é um sólido mais vítreo que cristalino.
É dito então que o B2QUALQUER3 É vítreo ou amorfo quando seus meninos de bo3 Eles estão bagunçados. Não apenas isso, mas também muda a maneira como eles se juntam. Em vez de pedir uma geometria trigonal, um anel de boroxol (imagem superior) termina para criar os pesquisadores (imagem superior).
Pode atendê -lo: 20 exemplos de energia químicaObserve a diferença óbvia entre unidades triangulares e hexagonais. Triangular caracterizar b2QUALQUER3 cristalino e hexagonal para B2QUALQUER3 vítreo. Outra maneira de se referir a esta fase amorfa é o vidro de boro, ou por meio de uma fórmula: G-B2QUALQUER3 (O 'g' vem da palavra vítrea, em inglês).
Assim, redes G-B2QUALQUER3 Eles são compostos de anéis de boroxol e não as unidades BO3. No entanto, o G-B2QUALQUER3 pode cristalizar para α-b2QUALQUER3, o que implicaria uma interconversão de anéis aos triângulos e também definirá o grau de cristalização alcançado.
Propriedades
Aparência física
É um sólido incolor e vítreo. Em sua forma cristalina, é branco.
Massa molecular
69.6182 g/mol.
Sabor
Ligeiramente amargo
Densidade
-Cristalino: 2,46 g/ml.
-Vitreous: 1,80g/ml.
Ponto de fusão
Não tem um ponto de fusão totalmente definido, porque depende de como é cristalino ou vítreo. A forma puramente cristalina derrete a 450ºC; No entanto, a forma vítrea derrete em uma faixa de temperatura que cobre de 300 a 700ºC.
Ponto de ebulição
Novamente, os valores relatados não correspondem a este valor. Aparentemente o óxido de boro líquido (derretido de seus cristais ou seu vidro) ferve a 1860ºC.
Estabilidade
Deve ser mantido seco, pois absorve a umidade para se transformar em ácido bórico, B (OH)3.
Nomenclatura
O óxido de boro pode ser nomeado de outras maneiras, como:
-Trioxide Diboro (nomenclatura sistemática).
-Óxido de boro (iii) (nomenclatura de estoque).
-Óxido bórico (nomenclatura tradicional).
Formulários
Alguns dos usos do óxido de boro são:
Síntese de Boro Trihalogenuros
De b2QUALQUER3 pode ser sintetizado por Trihalogenuros de Boro, BX3 (X = f, cl y br). Esses compostos são ácidos de Lewis e, com eles, é possível introduzir átomos de boro em certas moléculas para obter outros derivados com novas propriedades.
Pode servir a você: íons poliiatômicos: listar e exercíciosInseticida
Uma mistura sólida com ácido bórico, b2QUALQUER3-B (oh)3, representa uma fórmula usada como inseticida doméstica.
Solvente de óxidos de metal: formação de vidro, cerâmica e ligas de boro
O óxido de boro líquido é capaz de dissolver óxidos metálicos. A partir desta mistura resultante, uma vez resfriado, os sólidos compostos de boro e metais são obtidos.
Dependendo da quantidade de B2QUALQUER3 Usado, assim como a técnica e o tipo de óxido metálico, uma rica variedade de vidro (borossilicatos), cerâmica (nitretos e carbonetos de boro) e ligas podem ser obtidas (se apenas metais forem usados).
Em geral, vidro ou cerâmica adquirem maior resistência e força, e também maior durabilidade. No caso do vidro, eles acabam sendo usados para lentes ópticas e telescópicas e para dispositivos eletrônicos.
Encadernador
Na construção de fornos de fundição de aço, tijolos refratários com magnésio são usados. Neles, o óxido de boro é usado como fichário, ajudando a mantê -los fortemente unidos.
Referências
- Óxido bórico. Recuperado de: pubchem.NCBI.Nlm.NIH.Gov
- Óxido de borix. 20 Team Borax. Recuperado de: borax.com

