História do Tungstênio, Propriedades, Estrutura, Usos

- 2136
- 619
- Shawn Leffler
Ele tungstênio, Wolframio ou Volframium é um metal de transição pesado cujo símbolo químico é w. Está localizado no período 6 com o grupo 6 da tabela periódica, e seu número atômico é 74. Seu nome tem dois significados etimológicos: pedra dura e espuma de lobo; O segundo é porque este metal também é conhecido como Wolframio.
É um metal cinza prateado e, mesmo que seja frágil, tem grande dureza, densidade e alto fusão e pontos de ebulição. Portanto, tem sido usado em todas as aplicações que envolvem altas temperaturas, pressões ou forças mecânicas, como exercícios, projéteis ou radiação emitindo filamentos.
 Barra de tungstênio com sua superfície parcialmente oxidada. Fonte: imagens de alta resolução de elementos químicos [CC por 3.0 (https: // CreativeCommons.Org/licenças/por/3.0)]
Barra de tungstênio com sua superfície parcialmente oxidada. Fonte: imagens de alta resolução de elementos químicos [CC por 3.0 (https: // CreativeCommons.Org/licenças/por/3.0)] O uso mais conhecido deste metal, em um nível cultural e popular, está nos filamentos das lâmpadas elétricas. Quem os manipulou perceberá o quão frágeis são; No entanto, eles não são feitos de tungstênio puro, que é maleável e dúctil. Além disso, em matrizes de metal, como ligas, oferece excelente resistência e dureza.
É caracterizado e distinguido por ser o metal com o ponto mais alto de fusão e por ser também mais denso do que o mesmo líder, superado apenas por outros metais, como ósmio e iridium. É também o metal mais pesado que é conhecido por encontrar um papel biológico no corpo.
Na maioria de seus compostos iônicos, o ânion tungstate participa, wo42-, que pode polimerizar para causar grupos em um meio ácido. Por outro lado, o tungstênio pode formar compostos intermetálicos ou estritar com metais ou sais inorgânicos, para que seus sólidos adquiram formas ou consistências diferentes.
Não é muito abundante no córtex da Terra, tendo como uma tonelada de apenas 1,5 gramas deste metal. Além disso, por ser um elemento pesado, sua origem é intergaláctica; Especificamente das explosões das supernovas, que tiveram que jogar "jatos" de átomos de tungstênio em nosso planeta durante sua formação.
[TOC]
História
Etimologia
A história do tungstênio ou Wolframio tem dois rostos e seus nomes: um suíço e o outro alemão. Nos anos 1600, em regiões atualmente ocupadas pela Alemanha e pela Áustria, os mineiros trabalharam em extrações de cobre e estanho para produzir bronzes.
Até então, os mineiros encontraram um espinho no processo: havia um mineral extremamente difícil; Mineral consistia em Wolframite, (Faith, Mn, Mg) Wo4, que retinha ou "devorou" estanho como se fosse um lobo.
Daí a etimologia para esse elemento, 'lobo' de lobo em espanhol, um lobo que comeu lata; e 'carneiro' de espuma ou creme, cujos cristais se assemelhavam a um longo pêlo preto. Foi assim que o nome 'Wolfram' ou 'Wolframio' surgiu em homenagem a essas primeiras observações.
Em 1758, no lado suíço de um mineral semelhante, o Scheelita, Cawo4, Ele foi nomeado 'Tung Sten', que significa 'pedra dura'.
Ambos os nomes, Wolframio e Tungstênio, são amplamente utilizados de forma intercambiável, dependendo apenas da cultura. Na Espanha, por exemplo, e no oeste europeu, esse metal é mais conhecido por Wolframio; Enquanto estiver no continente americano, o nome de Tungstênio predomina.
Reconhecimento e descoberta
Sabe -se então que, entre os séculos XVII e XVIII, havia dois minerais: o Wolframite e o Scheelita. Mas quem vislumbrou que havia um metal diferente dos outros? Eles só podiam ser caracterizados como minerais, e foi em 1779 que o químico irlandês Peter Woulfe analisou cuidadosamente o Wolframite e deduziu a existência de Wolframium.
Pode atendê -lo: ácido perbrômico (hbro4): propriedades, riscos e usosNo lado suíço, novamente, Carl Wilhelm Scheele em 1781 foi capaz de isolar o tungstênio como wo3; E ainda mais, ele obteve ácido tumático (ou lolfâmico), h2Wo4 e outros compostos.
No entanto, isso não foi suficiente para alcançar o metal puro, porque era necessário reduzir esse ácido; isto é, sujeitá -lo a um processo que não puder oxigênio e cristalizar como metal. Carl Wilhelm Scheele não tinha a metodologia apropriada para esta reação de redução química.
É aqui que os irmãos espanhóis D'Aluyar, Fausto e Juan José, que reduziram os minerais (Wolframite e Scheelita) com carvão, na cidade de Bergara, na cidade de Bergara. Dois recebem o mérito e a honra de ser os descobertos do Wolframium ou Tungstênio Metálico (W).
Açaes e lâmpadas
 Qualquer lâmpada com filamento de tungstênio. Fonte: pxhere.
Qualquer lâmpada com filamento de tungstênio. Fonte: pxhere. Como outros metais, seus usos definem sua história. Entre os mais proeminentes até o final do século 19, estavam as ligas de aço-tungstênio e os filamentos de tungstênio para substituir o carbono dentro das lâmpadas elétricas. Pode-se dizer que as primeiras lâmpadas, como as conhecemos, foram comercializadas em 1903-1904.
Propriedades
Aparência física
É um metal cinza prateado e lustroso. Frágil, mas de grande dureza (não confusa com tenacidade). Se a peça é de alta pureza, ela se torna maleável e difícil, tanto quanto mais e vários aços.
Número atômico
74.
Massa molar
183,85 g/mol.
Ponto de fusão
3422ºC.
Ponto de ebulição
5930ºC.
Densidade
19,3 g/ml.
Calor de fusão
52,31 KJ/mol/mol.
Calor de vaporização
774 KJ/mol.
Capacidade de calor molar
24,27 KJ/mol.
MOH dureza
7.5.
Eletro-negatividade
2,36 na escala Pauling.
Rádio atômico
139 pm
Resistividade elétrica
52.8 nω · m a 20ºC.
Isótopos
Apresenta predominantemente na natureza como cinco isótopos: 182C, 183C, 184C, 186Varinha 180C. De acordo com a massa molar de 183 g/mol, que calcula a média das massas atômicas desses isótopos (e os outros trinta radioisótopos), cada átomo de tungstênio ou wolframium tem cerca de cento e dez nêutrons (74 + 110 = 184).
Química
É altamente resistente ao metal de corrosão, como sua fina camada de wo3 protege -o contra o ataque de oxigênio, ácido e álcalis. Uma vez dissolvido e precipitado com outros reagentes, seus sais são obtidos, que são chamados Wolframates ou Tungstates; Neles o tungstênio tem um estado de oxidação de +6 (assumindo que existem cátions w6+).
Agrupamento de ácido
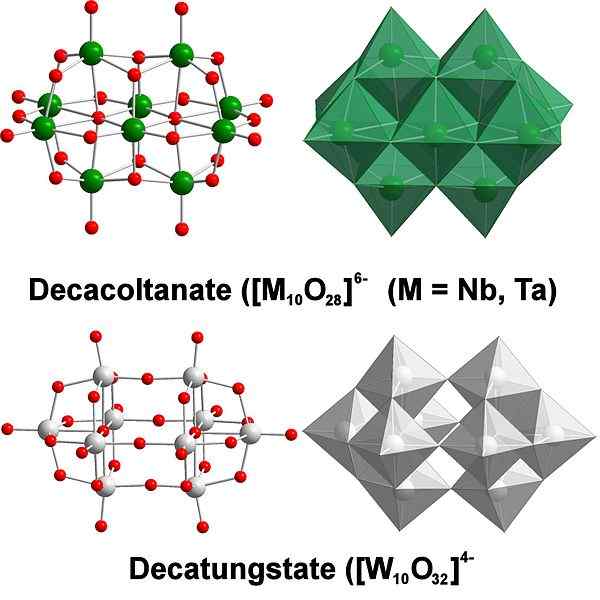 DecatungState, um exemplo de poliaxometalatos de tungstênio. Fonte: Scifanz [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)]
DecatungState, um exemplo de poliaxometalatos de tungstênio. Fonte: Scifanz [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)] Quimicamente o tungstênio é bastante particular porque seus íons tendem a ser agrupados (agrupamentos em inglês) para formar heteropolicidas ou poliaxometalato. Que são? São grupos ou aglomerados de átomos que se ligam para definir um corpo tridimensional; Principalmente, um com estrutura de gaiola esférica, na qual eles "envolvem" outro átomo.
Tudo começa no ânion tungstate, wo42-, Que em meio ácido é protonizado (HWO4-) e vinculado a um ânion vizinho para formar [w2QUALQUER7(OH)2]2-; E isso por sua vez se une a outro [w2QUALQUER7(OH)2]2- Para originar o [w4QUALQUER12(OH)4]4-. Então, até em solução, existem vários estados de politunidade.
Pode atendê -lo: cloreto de lítio (LiCl): propriedades, riscos e usosParathungstate a e b, [w7QUALQUER24]6- e h2C12QUALQUER4210-, respectivamente, eles são um dos mais destacados desses poliades.
Pode se tornar um desafio considerar suas estruturas de esboço e Lewis; Mas é o suficiente em princípio visualizá -los como Wo Octahedra Sets6 (Imagem superior).
Observe que esses octaedros acinzentados acabam definindo DecatungState, um político; Se um heteroácomo trava dentro (por exemplo, fósforo), seria então um poliaxometalato.
Estrutura e configuração eletrônica
Fases cristalinas
Os átomos de tungstênio definem uma estrutura cúbica centrada no corpo (BCC, por Cúbico centrado no corpo). Essa forma cristalina é conhecida como fase α; Enquanto a fase β também é cúbica, mas um pouco densa. As fases ou as formas cristalinas, α e β, podem coexistir em equilíbrio sob condições normais.
Os grãos cristalinos da fase α são isométricos, enquanto os da fase β se assemelham às colunas. Independentemente de como o vidro é, neste governo. Caso contrário, os pontos de fusão e ebulição altos não puderam ser explicados, ou a alta dureza e densidade do tungstênio.
Link de metal
Os átomos de tungstênio de alguma forma precisam ser muito unidos. Para aumentar uma conjectura, a configuração eletrônica deste metal deve ser observada antes:
[Xe] 4f145 d46s2
Os orbitais 5D são muito grandes e embaçados, o que implicaria que entre dois átomos próximos que existem sobreposições orbitais eficazes. Além disso, os orbitais 6s contribuem para as bandas resultantes, mas em menor grau. Enquanto os orbitais 4F tenham "muito no fundo" e sua contribuição, portanto, para o link metálico é menor.
Isso, o tamanho dos átomos e os grãos cristalinos, são as variáveis que determinam a dureza do tungstênio e sua densidade.
Estados de oxidação
No tungstênio ou no Wolframium metálico, os átomos w têm estado de oxidação zero (w0). Voltando à configuração eletrônica, os orbitais 5D e 6s podem "esvaziar" elétrons dependendo se W estiver na companhia de átomos muito eletronegativos, como oxigênio ou fluorina.
Quando os dois elétrons 6s são perdidos, o tungstênio tem estado de oxidação +2 (w2+), O que gera que seu contra -contra -contrato.
Se você também perder todos os elétrons de seus orbitais 5D, seu status de oxidação se tornará +6 (w6+); A partir daqui, não pode se tornar mais positivo (em teoria), uma vez que os orbitais 4F para serem internos exigiriam grandes energias para remover seus elétrons. Ou seja, o estado de oxidação mais positivo é +6, onde o tungstênio ainda tem pequeno.
Este tungstênio (VI) é muito estável em condições ácidas ou em muitos compostos oxigenados ou halogenados. Outros estados de oxidação positivos e possíveis são: +1, +2, +3, +4, +5 e +6.
O tungstênio também pode ganhar elétrons se combinado com menos átomos eletronegativos do que ele. Nesse caso, seus átomos se tornam maiores. Pode ganhar no máximo quatro elétrons; isto é, ter um estado de oxidação de -4 (w4-).
Obtenção
Anteriormente, foi mencionada que o tungstênio é encontrado em minerais de Wolframite e Scheelita. Dependendo do processo, dois compostos são obtidos a partir deles: óxido de tungstênio, wo3, ou amônio paratungstate (NH4)10(H2C12QUALQUER42) · 4h2O (ou ATP). Qualquer um deles dois pode ser reduzido a W metálico com carvão acima de 1050ºC.
Pode servir a você: Raault Law: Princípio e fórmula, exemplos, exercíciosNão é economicamente lucrativo. É por isso que é preferido produzi -lo na forma de poeira para lidar com outros metais para obter ligas.
Vale a pena mencionar que o mundo da China é o país com a maior produção de tungstênio. E no continente americano, Canadá, Bolívia e Brasil, eles também ocupam a lista dos maiores produtores deste metal.
Formulários
 Um composto de carboneto de tungstênio: um exemplo de como a dureza desse metal pode ser usada para imortalizar e endurecer materiais. Fonte: SolitarenAngel (Solitaryangel) [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)]
Um composto de carboneto de tungstênio: um exemplo de como a dureza desse metal pode ser usada para imortalizar e endurecer materiais. Fonte: SolitarenAngel (Solitaryangel) [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)] Alguns dos usos conhecidos para este metal são mencionados abaixo:
-Seus sais foram usados para colorir os algodões dos teatros antigos.
-Combinado com aço, endurece ainda mais, mesmo sendo capaz de resistir aos cortes mecânicos em alta velocidade.
-Os filamentos de sinterização de tungstênio são usados há mais de cem anos em lâmpadas elétricas e lâmpadas halogenadas. Além disso, devido ao seu alto ponto de fusão, serviu como material para os tubos de raios catódicos e para os bocais dos motores de foguetes.
-Substitui o chumbo na fabricação de projéteis e escudos radioativos.
-Os nanocáveis de tungstênio podem ser usados em nanodispositivos sensíveis ao pH.
-Catalisadores de tungstênio foram usados para lidar com a produção de enxofre na indústria de petróleo.
-O carboneto de tungstênio é de todos os seus compostos que cobrem mais usos. Desde o fortalecimento de cortes e ferramentas de perfuração, ou a fabricação de peças militares de armamentos, para mecanizar madeira, plásticos e cerâmica.
Riscos e precauções
Biológico
Sendo um metal relativamente raro na crosta terrestre, seus efeitos negativos são escassos. Em solos ácidos, os politungstados podem não afetar as enzimas usadas por molibdatos; Mas em solos básicos, o WO42- Ele intervém (positiva ou negativamente) nos processos metabólicos do moo42- e cobre.
As plantas, por exemplo, podem absorver os compostos solúveis do tungstênio e, ao comer um animal e depois de consumir sua carne, os átomos de W entram em nossos organismos. A maioria é expulsa em urina e fezes, e pouco se sabe o que acontece com o resto.
Estudos em animais mostraram que quando altas concentrações de pó de tungstênio desenvolvem sintomas semelhantes ao câncer de pulmão.
Por ingestão, um humano adulto precisaria beber milhares de galões de água enriquecidos com sais de tungstênio para mostrar inibição apreciável da colinesterase e enzimas da fosfatase.
Físico
Em termos gerais, o tungstênio é um elemento pouco tóxico e, portanto, existem poucos riscos do hospedeiro para danos à saúde.
Em relação ao tungstênio metálico, você deve evitar respirar seu pó; E se a amostra for sólida, deve -se levar em consideração que é muito denso e que pode causar danos físicos se cair ou atingir outras superfícies.
Referências
- Bell Terence. (s.F.). Tungstênio (Wolfram): Propriedades, produção, aplicações e ligas. O equilíbrio. Recuperado de: Thealance.com
- Wikipedia. (2019). Tungstênio. Recuperado de: em.Wikipedia.org
- Lentech b.V. (2019). Tungstênio. Recuperado de: lentech.com
- Jeff Desjardins. (1 de maio de 2017). A história do tungstênio, o metal natural mais forte da terra. Recuperado de: VisualCapitalist.com
- Doug Stewart. (2019). Fatos do elemento de tungstênio. Recuperado de: Chemicool.com
- Art Fisher e Pam Powell. (s.F.). Tungstênio. Universidade de Nevada. Recuperado de: Unce.a r.Edu
- Helmestine, Anne Marie, Ph.D. (2 de março de 2019). Fatos de tungstênio ou wolfram. Recuperado de: pensamento.com

