Transformações da matéria
- 1056
- 248
- Lonnie MacGyver
 As transformações da matéria são aquelas transformações que ela sofre sem mudar sua composição. Por exemplo, a água em sua forma líquida, sólida (gelo) ou refrigerante (vapor) permanece água
As transformações da matéria são aquelas transformações que ela sofre sem mudar sua composição. Por exemplo, a água em sua forma líquida, sólida (gelo) ou refrigerante (vapor) permanece água Quais são as transformações da matéria?
As transformações da matéria são as alterações de que isso está sofrendo sem sua composição mudando. Isto é, a matéria é transformada quando passa por mudanças físicas e químicas.
Exemplos de mudanças físicas são a formação de gelo quando a temperatura desce, o orvalho nas folhas que aparece de manhã, a dilatação dos objetos quando aquecida e a magnetização de um corpo.
Por sua parte, a oxidação de parafusos e pregos é uma mudança química, pois o óxido é uma substância diferente do ferro original. De qualquer forma, são necessárias mudanças na energia para que essas transformações ocorram.
A transformação do gelo é uma mudança de estado em que a água se solidifica, mas há mais possibilidades. A matéria ocorre na natureza e em laboratório em vários estados, dos quais gás, líquido e sólido são os três mais comuns, pelo menos em condições terrenas.
Mas, como a matéria está mudando, os cientistas encontraram mais estados, de natureza um tanto exótica, em base experimental e teórica.
Pode -se afirmar que existem cinco estados fundamentais da matéria:
- Sólido
- Líquido
- Gás
- Plasma
- Condensado de Bose-Einstein
Destes, os três primeiros são estáveis nas condições do nosso planeta, enquanto os dois últimos exigem meios tecnológicos para ocorrer, embora no universo sejam frequentes. O plasma é, de fato, o estado mais comum de matéria no cosmos.
Os estados fundamentais da matéria
Sob as condições de pressão e temperatura da Terra, a matéria é normalmente apresentada em três estados: sólido, líquido e gás, enquanto o plasma e os estados condensados de Bose-einstein são obtidos em diferentes condições, que podem ser alcançadas no laboratório.
Pode atendê -lo: medidas não convencionaisPara explicar o porquê, é necessário lembrar que a matéria é composta de partículas, ligadas por forças, tanto atraentes quanto repulsivas. Forças de atração, como o nome indica, tendem a montar as partículas, enquanto as repulsivas têm o efeito oposto.
Sólidos, líquidos e gases
Quando as forças de atração prevalecem entre as partículas, elas permanecem próximas umas das outras, juntas em posições mais ou menos fixas, dando origem ao sólidos. As partículas podem vibrar, mas não abandonar sua posição dentro do sólido, portanto, isso mantém uma forma e volume definidos.
Nos Líquidos, As forças de atração permitem que as partículas continuem nas proximidades, mas são menos intensas do que em sólidos, proporcionando -lhes a possibilidade de "escorregar" uns aos outros de uma certa maneira. Por esse motivo, os líquidos adaptam sua forma ao recipiente que os contém, mas mantêm seu volume fixo.
Finalmente, no Gases, Forças atraentes são ainda mais fracas, predominantemente forças de repulsa. Isso faz com que as partículas permaneçam bem longe uma da outra e com muito mais liberdade de movimento. Por esse motivo, os gases se expandem até que o volume disponível ocupe completamente.
Bose-Einstein condensam e condensam
Por gás de aquecimento suficientemente ionizacao, Dessa maneira, um plasma no laboratório. O estado plasmático não é fácil de ver naturalmente perto da terra, mas pode ser visto dele nas luzes norte e sul.
Este belo fenômeno natural ocorre quando as partículas do vento solar, um plasma bastante difuso, afetam a atmosfera da Terra, ionizando.
No outro extremo da escala, esfriando muito, logo acima do zero absoluto, aparece um novo estado de matéria em que a maioria das partículas está no estado fundamental, que é a energia mais baixa.
Pode atendê -lo: aspecto mais importante da pequena ciência, grande ciência e tecnociênciaEste estado de matéria é chamado Condensado de Bose-Einstein, pelos físicos Satyendra Bose e Albert Einstein, que previam sua existência em 1924.
Muitos anos depois, em 1995, vários cientistas conseguiram transportar gases muito diluídos para esse estado, uma tarefa fácil, considerando que as temperaturas de apenas nano-kelvin são necessárias acima do zero absoluto.
Mudanças do estado no assunto
Na natureza, é muito comum que a matéria passasse de um estado para outro. Normalmente, essas mudanças físicas são devidas a variações de pressão e temperatura, derivadas do aumento ou diminuição da energia das partículas.
Quando a energia térmica é adicionada a um material, a energia cinética de suas partículas aumenta, reduzindo a força de atração que as mantém em coesão. Se o material estivesse em estado sólido, ele pode se mover para o estado líquido ou até ir diretamente para o estado gasoso.
Pelo contrário, removendo energia térmica suficiente, é possível fazer um material gasoso se transformar em líquido, ou que passa de líquido para sólido. De qualquer forma, a composição da substância não muda.
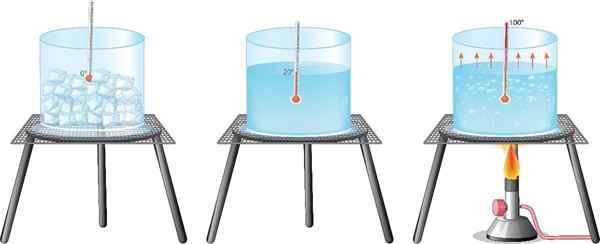
O exemplo mais familiar para todos é a água: é sabido que uma porção de água líquida é transformada em vapor quando é fervida, enquanto passa para resfriá -lo em um freezer.
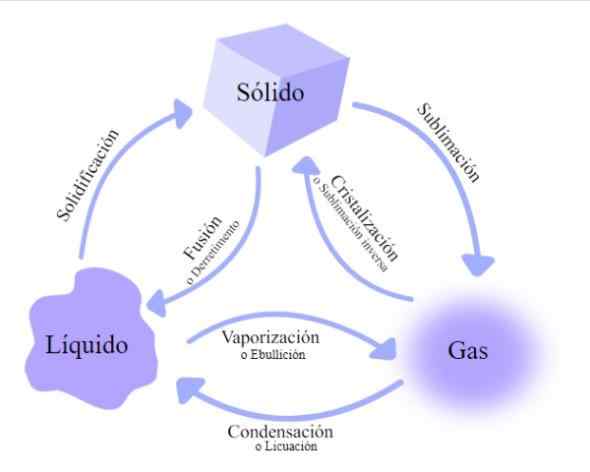 Mudanças no estado da matéria. Fonte: Wikimedia Commons
Mudanças no estado da matéria. Fonte: Wikimedia Commons Existem várias taxas de câmbio pelas quais a matéria passa, classificada de acordo com se a energia térmica aumenta ou diminui:
- Progressivo, Eles ocorrem quando o material absorve energia térmica.
- Regressivo, Eles são os que ocorrem quando o material produz energia.
Transformações progressivas
Entre as diferentes transformações progressivas que ocorrem no assunto, adicionando energia, estão:
Fusão
Mudança que ocorre quando o material passa de sua fase sólida para sua fase líquida. Por exemplo, derretendo um bloco de gelo ou calor ou cera em uma panela.
Vaporização
Nesse caso, o assunto é transformado pelo estado líquido para o estado gasoso.
Pode atendê -lo: metodologiaA vaporização ocorre de duas maneiras:
- Ebulição, ocorre quando o material atinge seu temperatura de ebulição, Dessa maneira, a energia é suficiente para superar forças intermoleculares que mantêm as partículas em seu estado líquido. Cada substância tem uma temperatura de ebulição característica, a uma certa pressão.
- Evaporação, Somente partículas superficiais mudam de estado, porque o material não está na temperatura necessária para entrar em fervura. O exemplo mais conhecido é a evaporação da água deixada em um recipiente, à temperatura ambiente.
Volatilização
Chamado também sublimação, Ocorre quando o material se converte diretamente do Solid Gas, sem passar pela fase líquida.
Por exemplo, gelo seco é dióxido de carbono2 volatilizado à temperatura ambiente. Naftaleno, que é usado para proteger as roupas de insetos, lentamente passa de ser sólido a ser um gás.
Ionizacao
É a passagem de um gás de plasma.
Transformações regressivas
São as transformações causadas pela diminuição da energia térmica das partículas. Entre eles estão:
Solidificação
É a mudança de matéria do estado líquido para o sólido por resfriamento, pois acontece ao colocar água no freezer. O processo é porque a substância gera energia para o ambiente frio, formando gelo.
Condensação
Ocorre ao passar do estado gasoso para a fase líquida, como no vapor de água no ar, ao fazer contato com a superfície fria do pára -brisa do carro.
Liquefação
É a transformação da matéria ao passar de gás para líquido, por acaso, resfriamento de amônia ou dióxido de carbono de alta pressão.
Sublimação inversa
Esta é a passagem da matéria em um estado gasoso a sólido, como no iodo gasoso que se chocam contra uma superfície fria, resultando na formação de cristais sólidos. Também é conhecido como cristalização.
Dessionização
Mudança do estado plasmático para o estado gasoso.
Referências
- Chang, R. (2013). Química. 11VA. Edição. Educação de McGraw Hill.
- Giancoli, d. (2006 =. Física: Princípios com aplicações. 6º. Ed Prentice Hall.
- Matéria e suas propriedades. Recuperado de: Elbibliote.com.
- OPENTAX. Química. Recuperado de: OpenStax.org.
- Shipman, j. (2009). Uma introdução à ciência física. Décima Segunda Edição. Brooks/Cole, Cengage Editions.

