Transaminação
- 1000
- 192
- Lonnie MacGyver
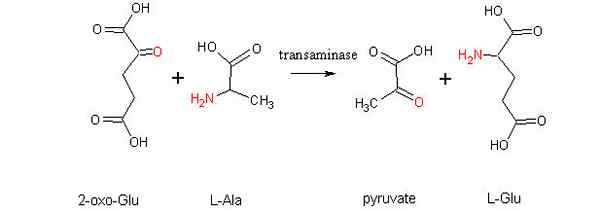
 Esquema de uma reação de aminotransferência entre um aminoácido e um alfa-zoácido (fonte: Alcibíades via Wikimedia Commons)
Esquema de uma reação de aminotransferência entre um aminoácido e um alfa-zoácido (fonte: Alcibíades via Wikimedia Commons) O que é transaminação?
O transaminação É um tipo de reação química que funciona na "redistribuição" dos grupos de aminoácidos, uma vez que envolve processos reversíveis de aminação (adição de um grupo amino) e desgosto (eliminação de um grupo amino), que são catalisados por enzimas específicas conhecido como transaminases ou aminotransferases.
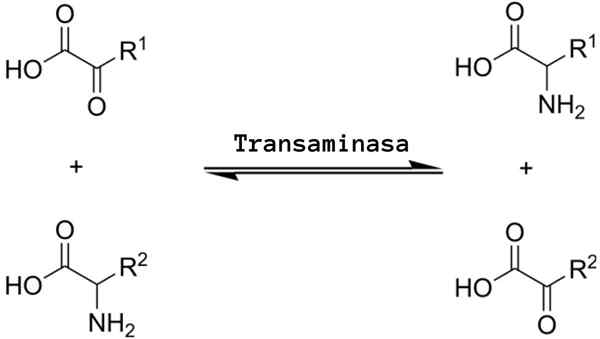
A reação geral da transaminação implica a troca entre um aminoácido e qualquer α-zo-stoat, onde a troca de um grupo amino produz a versão cetoácida do primeiro substrato aminoácido e a versão de aminoácidos do primeiro substrato α-zo-ectoácido.
O grupo amino que geralmente é trocado é o amino "alfa", ou seja, aquele que participa da formação dos ligações peptídicas e que define a estrutura dos aminoácidos, embora as reações que envolvam outros grupos amino presentes em diferentes posições em diferentes posições em Posições diferentes podem ocorrer em.
Com exceção da lisina, treonina, prolina e hidroxiprolina, todos os aminoácidos participam de reações de transaminação, embora para histidina, serina, métodina e fenilalanina tenham sido descritas transaminases, mas suas rotas metabólicas não implicam esse tipo de reação.
As reações de transaminação entre aminoácidos e α-cetóácidos foram descobertas em 1937 por Braunstein e Kritzmann, e desde então eles estão sujeitos a estudos intensos, pois ocorrem em muitos tecidos de diferentes organismos e com diferentes fins.
Nos seres humanos, por exemplo, as transaminases são amplamente distribuídas em tecidos corporais e são particularmente ativos no tecido muscular cardíaco, no fígado, no tecido muscular esquelético e nos rins.
Mecanismo de reação
As reações de transaminação implicam mais ou menos o mesmo mecanismo. Como mencionado acima, essas reações ocorrem como uma troca reversível de um grupo amino entre um aminoácido e um α-zo-CID.
Pode servir a você: materiais de cerâmica: características, tipos, exemplosEssas reações dependem de um composto conhecido como piridoxal de fosfato, um derivado de vitamina B6 que participa como um transportador de grupo amino e se liga às enzimas transaminase através da formação de uma base de Schiff entre o grupo aldeído dessa molécula e a ε-amino de A a resíduo de lisina no local ativo da enzima.
A união entre o piridoxal fosfato e o resíduo de lisina no local ativo não é covalente, mas é dada através da interação eletrostática entre a carga positiva de nitrogênio na lisina e a carga negativa no grupo fosfato do piridoxal.
No decorrer da reação, o aminoácido que funciona como um substrato desloca o grupo ε-amino do resíduo de lisina no local ativo que participa da base de Schiff com o piridoxal.
Enquanto isso, um par de elétrons de carbono alfa de aminoácidos é removido e transferido para o anel de piridina que compõe o piridoxal fosfato (com uma carga positiva) e, em seguida, eles são "entregues" a α-zo-zid que funciona como um segundo substrato.
Dessa maneira, o fosfato piridoxal não apenas participa da transferência ou transporte dos aminoácidos entre os aminoácidos e os α-ectoácidos que são substratos das transaminases, mas também age como um "afundamento" de elétrons, facilitando a dissociação de o hidrogênio do ácido alfa.
Em resumo, o primeiro substrato, um aminoácido, transfere seu grupo amino para o piridoxal fosfato, de onde é posteriormente transferido para o segundo substrato, um α-zo-ectoide, formando, no intermediário, um composto intermediário conhecido como piridoxamina fosfato.
Pode atendê -lo: cromatografia em colunaFunção de transaminação
As enzimas transaminase são geralmente encontradas em citosol e mitocôndrias e trabalham na integração de diferentes rotas metabólicas.
A glutamato desidrogenase em sua reação inversa, por exemplo, pode transformar glutamato em amônio, nadh (ou nadph) e α-zetoglutarato, que pode entrar no ciclo de ácidos tricarboxílicos e função na produção de energia.
Essa enzima, que está na matriz mitocondrial, representa um ponto de ramo que associa aminoácidos ao metabolismo energético, de modo que, quando uma célula carece de energia suficiente na forma de carboidratos ou gorduras para funcionar, pode usar alternadamente alguns aminoácidos para os mesmos propósito.
A formação da enzima (glutamato desidrogenase) durante o desenvolvimento do cérebro é essencial para o controle da desintoxicação de amônio, pois foi demonstrado que alguns casos de retardo mental têm a ver com uma baixa atividade disso, o que leva ao acúmulo de amônio, o que é prejudicial à saúde do cérebro.
Em algumas células hepáticas, as reações de transaminação também podem ser usadas para a síntese de glicose de gliconeogênese.
A glutamina é convertida em glutamato e amônio pela enzima glutaminase. Então, o glutamato é convertido em α-zetoglutarato, que entra no ciclo de Krebs e depois para a gliconeogênese. Esta última etapa ocorre graças ao Malo, um dos produtos da rota, é transportado para fora das mitocôndrias por meio de um ônibus espacial.
Este traslado deixa α-cetoglutarato na misericórdia da enzima Málica, o que o torna piruvato. Duas moléculas de piruvato podem ser convertidas e, em seguida, uma molécula de glicose através da gliconeogênese.
Pode servir você: frasco de fundo planoExemplos
As reações de transaminação mais comuns estão relacionadas a aminoácidos de alanina, ácido glutâmico e ácido aspártico.
Algumas enzimas aminotransferase podem, além do fosfato piridoxal, usar piruvato como "coenzima", como é o caso da transaminase glutamato-piruvato, que catalisa a seguinte reação:
glutamato + piruvato ↔ alanina + α-cetoglutarato
As células musculares dependem dessa reação para produzir alanina a partir de piruvato e obter energia através do ciclo Krebs por meio de α-zetoglutorory. Nessas células, o uso de alanina como fonte de energia depende da eliminação de grupos amino como íons de amônio no fígado, através do ciclo da uréia.
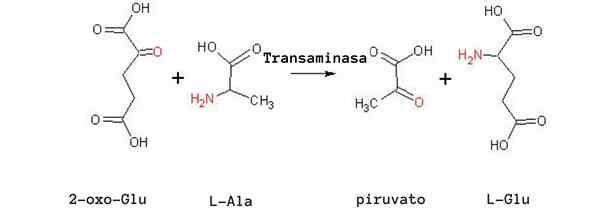 Reação de transaminação de alanina (Fonte: Tomas Drab [domínio público] via Wikimedia Commons)
Reação de transaminação de alanina (Fonte: Tomas Drab [domínio público] via Wikimedia Commons) Outra reação de transaminação muito importante em diferentes espécies é a catalisada pela enzima aspartato aminotransferase:
L-spartato + α-cetoglutarato ↔ oxalacetato + l-glutamato
Finalmente, mas não menos importante, a reação da transaminação com ácido γ-aminobutírico (GABA), um aminoácido não proteico para o sistema nervoso central que funciona como um neurotransmissor inibidor. A reação é catalisada por um ácido da transaminase γ-aminobutirica e é mais ou menos como se segue:
α-cetoglutarato + ácido 4-aminobutanóico ↔ glutamato + semi-carro succínico
A semi -succínica semi -uso é convertida em ácido succínico por uma reação de oxidação e este último pode entrar no ciclo Krebs para produção de energia.

