Estrutura de tolueno, propriedades, usos, obtenção
- 3814
- 244
- Alfred Kub
Ele Tolueno É um hidrocarboneto aromático cuja fórmula condensada é C6H5CH3 ou phch3 e isso consiste em um grupo metil (CH3) junto com um anel benzênico ou grupo fenil (pH). É encontrado naturalmente em petróleo bruto, em carvão, em emanações vulcânicas e em algumas árvores, como o Tolú de América no sul.
Este solvente de cheiro característico é usado principalmente como matéria -prima industrial e como um diluente de tinta. Também é usado na eliminação de parasitas presentes em gatos e cães, como ascarídeos e anylostomes.
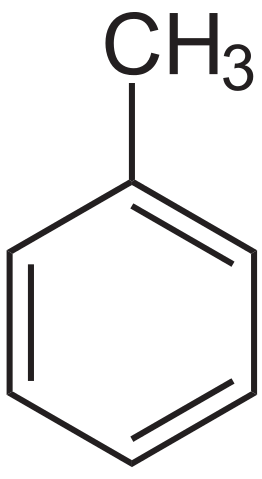
 Fórmula estrutural de tolueno. Fonte: Neurotoger via Wikipedia.
Fórmula estrutural de tolueno. Fonte: Neurotoger via Wikipedia. O tolueno foi isolado pela primeira vez por Pierre-Joseph Pelletier e Philippe Walter, em 1837, de Pine Oil. Posteriormente, Henri Etienne Sainte-Claire Deville, em 1841, isolou-o do Balm Tolú e apontou que seu produto era semelhante ao isolado anteriormente. Em 1843, Berzelius o batizou como toluin.
A maior parte do tolueno é obtida como um produto lateral ou secundário em processos de produção de gás e conversão de carvão em Coca -Cola. Também é produzido por reações feitas em laboratório, por exemplo, a reação benzeno com o cloreto de metila.
[TOC]
Estrutura
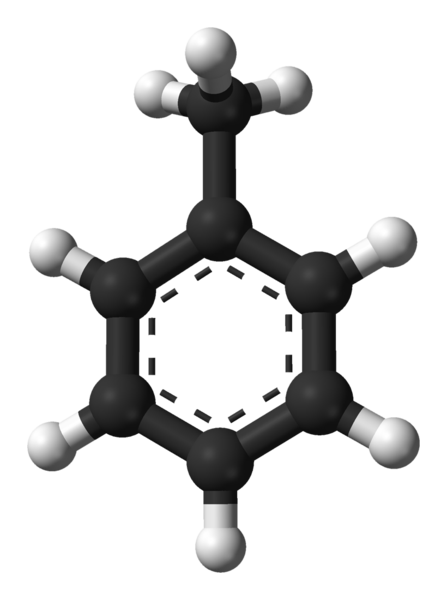 Estrutura molecular do tolueno. Fonte: Ben Mills via Wikipedia.
Estrutura molecular do tolueno. Fonte: Ben Mills via Wikipedia. Na imagem superior, temos a estrutura molecular do tolueno representado por um modelo de esferas e barras. Observe que parece exatamente o mesmo que a fórmula estrutural indicada, com a diferença de que não é uma molécula plana completamente.
No centro do anel benzeno, que neste caso pode ser visto como um grupo fenil, pH, seu caráter aromático é destacado através das linhas pontilhadas. Todos os átomos de carbono têm hibridação de SP2, Exceto pelo grupo CHO3, cuja hibridação é sp3.
É por esse motivo que a molécula não é completamente plana: hidrogênios CHO3 Eles estão localizados em diferentes ângulos do plano de anel benzênico.
Pode atendê -lo: constante de ionizaçãoTolueno é uma molécula apolar, hidrofóbica e aromática. Suas interações intermoleculares são baseadas nas forças dispersivas de Londres e nas interações dipolo-dipolo, uma vez que o centro do anel é "carregado" de densidade eletrônica fornecida pelo CH3; Enquanto os átomos de hidrogênio têm baixa densidade eletrônica.
Portanto, o tolueno tem vários tipos de interações intermoleculares que mantêm as moléculas de seu coesivo líquido. Isso se reflete em seu ponto de ebulição, 111 ° C, que é alto, considerando que é um solvente apolar.
Propriedades
Aparência física
Líquido incolor e transparente
Massa molar
92.141 g/mol
Cheiro
Doce, acre e semelhante ao de benzeno
Densidade
0,87 g/ml a 20 ºC
Ponto de fusão
-95 ºC
Ponto de ebulição
111 ºC
Solubilidade
O tolueno tem solubilidade desprezível na água: 0,52 g/L a 20 ° C. Isso devido à diferença de polaridades entre tolueno e água.
Por outro lado, o tolueno é solúvel, ou neste caso miscível, com etanol, benzeno, éter etil, acetona, clorofórmio, ácido acético glacial e dissulfeto de carbono; isto é, é melhor solubilizado em solventes menos polares.
Índice de refração (nD)
1.497
Gosma
0,590 cp (20 ºC)
ponto de ignição
6 ºC. O tolueno deve ser manipulado em campos de extração de gás e o mais longe possível de qualquer chama.
Densidade do vapor
3.14 em relação aérea = 1. Ou seja, seus vapores são três vezes mais densos que o ar.
Pressão de vapor
2.8 kPa a 20 ° C (cerca de 0.27 atm).
Temperatura de auto -ignição
480 ° C
Decomposição
Pode reagir vigorosamente com materiais oxidantes. Quando aquecido para decomposição, ele emite um acre e fumaça irritante.
Tensão superficial
29,46 mn a 10 ºC
Momento dipolar
0,36 d
Reatividade
O tolueno é propenso à cloração a produzir orto-clorotolueno e para-clorotoluen. Também é fácil nitrificar produzir nitrotolueno, que é a matéria -prima dos corantes.
Pode atendê -lo: peso atômicoUma parte do tolueno é combinada com três partes de ácido nítrico para causar trinitrotolueno (TNT): um dos explosivos mais conhecidos.
Da mesma forma, o tolueno experimenta a sulfonação para gerar ácidos o-toluen-sulfônico e toluen-sulfônico, que são a matéria-prima para a fabricação de corantes e sacarina.
O grupo metílico de tolueno experimenta perda de hidrogênio devido à ação de uma base forte. O grupo metil também é suscetível à oxidação, por isso reage com o permanganato de potássio para causar originária de ácido benzóico e benzaldeído.
Formulários
Industriais
 O TNT, o explosivo mais simbólico de todos, ocorre pelo tolueno como a principal matéria -prima. Fonte: Pixabay.
O TNT, o explosivo mais simbólico de todos, ocorre pelo tolueno como a principal matéria -prima. Fonte: Pixabay. O tolueno é usado na elaboração de pinturas, diluentes de tintas, unhas polidas, adesivos ou gengivas de pasta, lacas, tintas, nylon, plástico, espuma de poliuretano, a maioria dos óleos, órgãos de vinil, medicamentos, corantes, perfumes, explosivos (TNT).
Da mesma maneira, o tolueno é usado na forma de toluenossulfonados na fabricação de detergente. O tolueno também é de grande importância na fabricação de cimentos plásticos, apostas cosméticas, anticongelantes, tintas, asfalto, marcadores permanentes, cimentos de contato, etc.
Solvente e diluente
O tolueno é usado na diluição das pinturas, o que facilita sua aplicação. É usado para dissolver as bordas dos kits de poliestireno, permitindo assim a união das partes que constituem modelos de aeronaves em escala. Além disso, é usado na extração de produtos naturais de plantas.
Tolueno é um solvente de tinta usado no orifício gravado. Cimentos misturados com borracha e tolueno são usados para cobrir um grande número de produtos. Da mesma forma, o tolueno é usado como solvente em tintas impressas, lacas, curteiros de couro, cola e desinfetantes.
Pode atendê -lo: absorção molarE ainda mais interessante, o tolueno é usado como um solvente de nanomateriais de carbono (como nanotubos) e fulerenosos.
Outros
Uma mistura de benzeno, tolueno e xileno (BTX) é adicionada à gasolina para aumentar seu octano. Tolueno é um aditivo de gás de avião e reserva de alta octanagem. Também é usado na elaboração do NAFTA.
O tolueno ajuda na eliminação de algumas espécies de ascárrides e anquilostomos, bem como tenias que são parasitas de gatos e cães.
Obtenção
A maior parte do tolueno é obtida a partir de produtos destilados a partir de petróleo bruto, gerado durante a pirólise de hidrocarbonetos (rachaduras a vapor). A reforma catalítica dos vapores de petróleo representa 87 % do tolueno produzido.
9 % adicionais de tolueno da pirólise a gasolina produzida durante a fabricação de etileno e propileno.
A Hulla Tar de fornos de Coca -Cola contribui com 1 % do tolueno produzido, enquanto os 2 % restantes são obtidos como um subproduto da fabricação do alongamento.
Efeitos prejudiciais
O tolueno é um solvente que é inalado para ficar alto, pois tem uma ação narcótica que afeta o funcionamento do sistema nervoso central. Tolueno entra no corpo para ingestão, inalação e absorção através da pele.
Em um nível de exposição de 200 ppm, excitação, euforia, alucinações, percepções distorcidas, dor de cabeça e tontura podem ocorrer. Enquanto níveis mais altos de exposição a tolueno podem produzir depressão, sonolência e estupor.
Quando a inalação excede uma concentração de 10.000 ppm, é capaz de produzir a morte do indivíduo devido a insuficiência respiratória.
Referências
- Graham Solomons t.C., Craig b. Fryhle. (2011). Química orgânica. (10º Edição.). Wiley Plus.
- Carey f. (2008). Quimica Organica. (Sexta edição). Mc Graw Hill.
- Morrison e Boyd. (1987). Quimica Organica. (Quinta edição). Addison-Wesley Iberoamericana.
- Centro Nacional de Informações sobre Biotecnologia. (2020). Tolueno. Banco de dados PubChem., CID = 1140. Recuperado de: pubchem.NCBI.Nlm.NIH.Gov
- Wikipedia. (2020). Tolueno. Recuperado de: em.Wikipedia.org
- Caixa de ferramentas de engenharia, (2018). Tolueno - Propriedades termofísicas. [Online] Recuperado de: EngineeringToolbox.com
- Vedantu. (s.F.). Tolueno. Recuperado de: Vedantu.com
- « Fórmula de interferência destrutiva e equações, exemplos, exercícios
- Estrutura de polivinilpirrolidona, propriedades, usos, efeitos colaterais »

