Características da tirosina, estrutura, funções, benefícios
- 2290
- 440
- Conrad Schmidt
O Tirosina (Tyr, y) é um dos 22 aminoácidos que compõem as proteínas de todas as células presentes nos seres vivos. Ao contrário de outros aminoácidos, como valina, treonina, triptofano, leucina, lisina e outros, a tirosina é um aminoácido "condicionalmente" essencialmente essencial.
O nome "tirosina" deriva da palavra grega "tiroteio", o que significa queijo, porque este aminoácido foi descoberto pela primeira vez neste alimento. O termo foi cunhado em 1846 por Liebig, que misturou queijo com hidróxido de potássio e obteve um composto desconhecido, dificilmente solúvel em água.
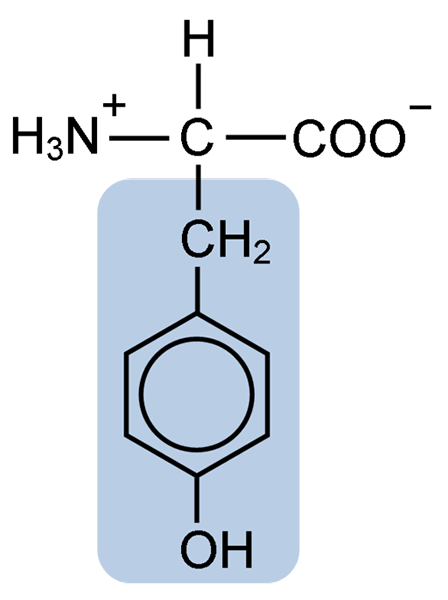
 Estrutura química do aminoácido tirosina (fonte: clavecina [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)] via Wikimedia Commons)
Estrutura química do aminoácido tirosina (fonte: clavecina [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)] via Wikimedia Commons) Após a descrição inicial, outros pesquisadores como Warren de la Rue e Hinterberger obtidos de insetos de cocóides e proteínas de chifres, respectivamente. Sua separação da hidrólise de outras proteínas com ácido clorídrico foi descrito em 1901 por Mörner.
Geralmente, esse aminoácido é obtido em mamíferos graças à hidroxilação da fenilalanina, embora também seja absorvida no intestino das proteínas consumidas com alimentos.
A tirosina tem múltiplas funções no corpo humano e, entre elas.
[TOC]
Caracteristicas
A tirosina pesa aproximadamente 180 g/mol e seu grupo de cadeia lateral ou r ou uma constante de 10 -dissociação 10.07. Sua abundância relativa nas proteínas celulares não excede 4%, mas tem várias funções essenciais para a fisiologia humana.
Este aminoácido pertence ao grupo de aminoácidos aromáticos, nos quais a fenilalanina e o triptofano também são. Os membros deste grupo têm anéis aromáticos em suas correntes rm ou laterais e, geralmente, são aminoácidos hidrofóbicos ou apolares.
Como o triptofano, a tirosina absorve a luz ultravioleta e é um dos resíduos de aminoácidos responsáveis pela absorvância da luz a 280 nm de muitas proteínas, por isso é útil para sua caracterização.
É considerado um aminoácido "condicionalmente" essencial, pois sua biossíntese no ser humano depende da fenilalanina, um aminoácido essencial. Se o corpo satisfazer seus requisitos diários de fenilalanina, a tirosina pode ser sintetizada sem problemas e não é um aminoácido limitador.
No entanto, se a dieta estiver faltando em fenilalanina, o corpo não apenas terá um desequilíbrio desse aminoácido, mas também de tirosina. Também é importante ressaltar que a reação da síntese de tirosina da fenilalanina não é reversível, de modo que a tirosina não pode atender às necessidades celulares da fenilalanina.
A tirosina também pertence ao grupo de aminoácidos com funções duplas na produção de intermediários metabólicos glicogênicos e cetogênicos, que participam da síntese de glicose para o cérebro e na formação de corpos de cetona no fígado.
Estrutura
Como o restante dos aminoácidos, a tirosina ou o ácido β-pa-pe-hidroxifenil-α-amino-propiônico, é um α-aminoácido que possui um átomo de carbono central, chamado carbono α e que é quiral, porque está ligado a quatro átomos ou moléculas substituintes diferentes.
Este carbono quiral está ligado a dois grupos característicos de aminoácidos: um grupo amino (NH2) e um grupo carboxil (COOH). Ele também compartilha um de seus títulos com um átomo de hidrogênio e a ligação restante é ocupada pela cadeia R ou lateral de cada aminoácido.
No caso da tirosina, esse grupo consiste em um anel aromático associado a um grupo hidroxil (OH), o que lhe dá a capacidade de formar pontes de hidrogênio com outras moléculas e que lhe confere características funcionais essenciais para certas enzimas.
Pode atendê -lo: barorreceptoresFunções
A tirosina é um componente fundamental de muitas proteínas com grande diversidade de atividades e funções biológicas.
Em humanos e outros mamíferos, esse aminoácido é aproveitado nos tecidos nervosos e renais para a síntese de dopamina, adrenalina e norepinefrina, três neurotransmitores relacionados a catecolaminérgicos relacionados à total importância para o funcionamento do corpo.
Também é essencial para a síntese de protetores de radiação ultravioleta (UV), como a melanina; de alguns analgésicos, como endorfinas e moléculas antioxidantes, como a vitamina E.
Da mesma forma, este aminoácido serve para a síntese de hormônios de tiramina, octopamina e tireóide através da organização de iodo no resíduo tirosina da tioglobulina.
Tiramine é uma molécula vasoativa encontrada no corpo humano e a octopamina é uma amina relacionada à noreprenalina.
Todas essas funções da tirosina são possíveis graças à obtenção das proteínas da dieta ou pela hidroxilação da fenilalanina com o fígado como o principal sistema de suprimento sistêmico do referido aminoácido.
Funções em plantas
A tirosina e alguns dos intermediários gerados durante sua biossíntese alimentam as rotas biossintéticas de metabólitos especializados em defesa, na atração de polinizadores, em transporte eletrônico e suporte estrutural.
Biossíntese
No ser humano, a tirosina é obtida da dieta ou sintetizada em uma única etapa por células hepáticas da fenilalanina, um aminoácido essencial, através do reação catalisada pelo complexo enzimático da hidroxilase de fenilalanina.
Este complexo tem atividade de oxigenase e só está presente no fígado de humanos ou outros mamíferos. A reação da síntese da tirosina implica, então, a transferência de um átomo de oxigênio para a posição para do anel aromático da fenilalanina.
Essa reação ocorre ao mesmo tempo em que uma molécula de água é formada devido à redução de outro átomo de oxigênio molecular e a potência redutora é contribuída diretamente por um NADPH conjugado com uma molécula de tetra -hidropterina, que é semelhante ao ácido fólico.
Biossíntese em plantas
Nas plantas, a tirosina é sintetizada de Novo A jusante da rota "Shikimato", que alimenta outras rotas biossintéticas de outros aminoácidos aromáticos, como fenilalanina e triptofano.
Nesses organismos, a síntese é baseada em um composto conhecido como "corismato", que é o produto final da rota Shikimato e, além disso, o precursor comum para todos os aminoácidos aromáticos, certas vitaminas e hormônios vegetais.
O corismato é convertido em prefácio pela ação catalítica da enzima corismate mutasa e este é o primeiro passo "comprometido" na síntese de tirosina e fenilalanina nas plantas.
O predeneato é convertido em tirosina por uma descarboxilação oxidativa e uma transaminação, que pode ocorrer em qualquer ordem.
In one of the biosynthetic routes, these steps can be catalyzed by specific enzymes known as prefenate-specific dehydrogenase (PDH) (which converts the preface into 4-hydroxyphenylpyphenylpyruvate (HPP)) and tyrosine aminotransferase (which produces the tyrosine from the HPP ), respectivamente.
Outro caminho de síntese de tirosina do prefácio implica a transaminação do predeneato para um aminoácido não proteinogênico chamado L-arogenato, catalisado pela enzima prede aminotransferase.
O L-arogenato está subsequentemente sujeito à descarboxilação oxidativa para formar tiroxina, uma reação direcionada por uma desidrogenase específica de arogenato de tirosina da enzima, também conhecida como ADH.
As plantas usam preferencialmente a rota do arenato, enquanto a maioria dos micróbios sintetiza a tirosina do HPP derivado do predenensate.
Regulamento
Como é verdade para a maioria das rotas biossintéticas dos aminoácidos, as plantas têm um sistema estrito de regulação da síntese de aminoácidos aromáticos, incluindo tirosina.
Pode atendê -lo: monstro delicioso: características, habitat, cuidado, propriedadesNesses organismos, a regulamentação ocorre em muitos níveis, uma vez que os mecanismos que controlam a rota Shikimato também controlam a produção de tirosina, uma rota para a qual também existem seus próprios mecanismos de regulamentação.
No entanto, os requisitos da tirosina e, portanto, a rigidez na regulação de sua biossíntese, são específicos para cada espécie de planta.
Degradação
A degradação ou catabolismo da tirosina resulta na formação de fumarato e acetoacetato. A primeira etapa desta rota consiste na conversão do aminoácido em 4-hidroxifenilpipato por uma enzima citosólica conhecida como aminotransferase tirosina.
Este aminoácido também pode ser transaminado nas mitocôndrias dos hepatócitos por uma enzima aspartato de aminotransferase, embora essa enzima não seja muito importante em condições fisiológicas normais.
Através da degradação da tirosina, a succinil-acetoacetato pode ocorrer, que pode ser descarboxilado ao succinil-acetato. O succinil-acetato é o inibidor da enzima mais poderoso responsável pela síntese do grupo Hemo, a 5-aminolevulina ácida ácido desidratase.
Síntese de adrenalina e norepinefrina
Como mencionado, a tirosina é um dos principais substratos para a síntese de dois neurotransmissores muito importantes para o corpo humano: adrenalina e norepinefrina.
Isso é inicialmente usado por uma enzima conhecida como tirosina hidroxilase, capaz de adicionar um grupo hidroxila adicional ao anel aromático do grupo Ri tirosina R, que forma o composto conhecido como dopa.
O dopa dá origem à dopamina quando é processado enzimaticamente por uma enzima dopa decboxilas.
A dopamina é posteriormente convertida em noreprenalina pela ação da enzima de dopamina β -oxidase, que catalisa a adição de um grupo hidroxila a -Ch que fazia parte do grupo R da tirosina e que funcionou como uma "ponte" entre o anel aromático e carbono α.
A adrenalina deriva da norepinefrina pela ação da fenitanolamina N-A metiltransferase, responsável pela transferência dependente de S-adenosil-mecionina de um grupo metil (-CH3) para o grupo amino livre de norepinefrina.
Alimentos ricos em tirosina
Como mencionado acima, a tirosina é um aminoácido "condicionalmente" essencial, pois é sintetizado no corpo humano por hidroxilação da fenilalanina, um aminoácido essencial.
Portanto, se a ingestão de fenilalanina cobre as demandas corporais, a tirosina não é um fator limitante para o funcionamento normal das células. A tirosina, no entanto, também é adquirida de proteínas que são consumidas com alimentos diários.
Alguns estudos relatam que a ingestão diária mínima de tirosina e fenilalanina deve estar entre 25 e 30 mg por quilograma de peso; portanto, uma pessoa comum deve consumir mais ou menos 875 mg de tirosina por dia.
Alimentos com maior teor de tirosina são queijo e soja. Entre eles também estão carne bovina, cordeiro, carne de porco, frango e peixe.
Algumas sementes e nozes, como nozes, também conferem contribuições significativas deste aminoácido, além de ovos, produtos lácteos, grãos e cereais.
Benefícios da sua ingestão
A tirosina é comumente consumida na forma de suplementos alimentares ou nutricionais, especificamente para o tratamento da patologia conhecida como fenilcetonúria, sofrida por pacientes incapazes de processar adequadamente a fenilalanina e, portanto, não produzem tirosina.
Pode servir você: função de relacionamentoPensa -se que um aumento na quantidade de tirosina consumida por dia possa melhorar as funções cognitivas relacionadas à aprendizagem, memória e alerta de estado em condições estressantes, uma vez que seu catabolismo está relacionado à síntese de adrenalina e neurotransmissores norapineniais.
Algumas pessoas tomam comprimidos ricos em Tirosin para permanecer alerta durante o dia, se tiver perdido uma quantidade significativa de horas de sono.
Como esse aminoácido participa da formação do hormônio da tireóide, seu consumo pode ter efeitos positivos na regulação metabólica sistêmica.
Distúrbios de deficiência
Albinismo e alcaptonúria são duas patologias relacionadas ao metabolismo da tirosina. A primeira condição está relacionada à síntese defeituosa da melanina da tirosina e a segunda tem a ver com defeitos na degradação da tirosina.
O albinismo é caracterizado pela falta de pigmentação na pele, ou seja, os pacientes que sofrem com ela têm cabelos brancos e pele rosada, porque a melanina é o pigmento responsável por fornecer cores a essas estruturas.
Essa patologia tem a ver com uma deficiência na tirosinase específica dos melanócitos, responsável pela conversão da tirosina em dopa-quinona, um intermediário na síntese de melanina.
Os sintomas da alcaptonúria são evidentes como uma pigmentação de urina exagerada (escura) e artrite de desenvolvimento tardio.
Outras patologias metabólicas
Além disso, existem outros distúrbios relacionados ao metabolismo da tirosina, entre os quais estão:
- Tirosinemia hereditária do tipo I: caracterizada por degeneração progressiva do fígado e disfunção renal
- Tirosinemia hereditária da síndrome do tipo II ou Richner-Hanhart: que é evidente como queratite e lesões ampulares nas palmas das mãos e solas dos pés
- Tipo III tirosinemia: que pode ser assintomático ou presente como atrasos mentais
- "Hawkinsinúria": caracterizado por acidose metabólica na infância e a incapacidade de prosperar no crescimento
Existem também outros defeitos inatos no metabolismo da merosina que têm a ver com deficiências nas enzimas responsáveis por sua degradação, como a hidroxilase tirosina, responsável pela primeira etapa da síntese de dopamina da tirosina.
Referências
- Aders Plimmer, r. (1908). A constituição química das proteínas. deixei. Londres, Reino Unido: Longmans, Green e Co.
- Chakrapani, a., Gissen, p., & McKiernan, P. (2012). Distúrbios do metabolismo da tirosina. Em Desejo metabólico inato: diagnóstico e tratamento (pp. 265-276).
- Kretchmer, n., Levine, s., McNamara, h., & Barnett, H. (1956). Certos aspectos do metabolismo da tirosina nos jovens. Yo. O desenvolvimento do sistema de oxidação da tirosina no fígado humano. O Journal of Clinical Investigation, 35(10), 1089-1093.
- Du, b., Zannoni, v., LASTER, l., & Seegmiller, e. (1958). A natureza do defeito no metabolismo da tirosina em Alkaptonuria. Jornal de Química Biológica, 230, 251-260.
- Murray, r., Bender, d., Botham, k., Kennelly, p., Rodwell, v., & Weil, P. (2009). Bioquímica ilustrada de Harper (28ª ed.). McGraw-Hill Medical.
- Nelson, d. eu., & Cox, M. M. (2009). Lehninger Principles of Biochemistry. Edições Omega (5ª ed.).
- Schenck, c. PARA., & Maeda, H. PARA. (2018). Biossíntese de tirosina, metabolismo e catabolismo em plantas. Fitoquímica, 149, 82-102.
- Slominski, a., Zmijewski, m. PARA., & Paweley, J. (2012). L-Tyrosina e L-Di-hidroxifenilalanina como reguladores do tipo hormônio de funções de melanócitos. Pigmment Cell and Melanoma Research, 25(1), 14-27.
- Van de, g. (2018). Linha de saúde. Recuperado em 16 de setembro de 2019, da www.Healthline.com
- Md web. (n.d.). Recuperado em 15 de setembro de 2019, da www.Webmd.com
- Whitbread, d. (2019). Meus dados alimentares. Recuperado em 15 de setembro de 2019, da www.Myfooddata.com
- « Funções de assistência social, tipos, estabelecimentos no México
- Método Tachtenberg O que é, exemplos »

