Tioles
- 2210
- 48
- Gilbert Franecki
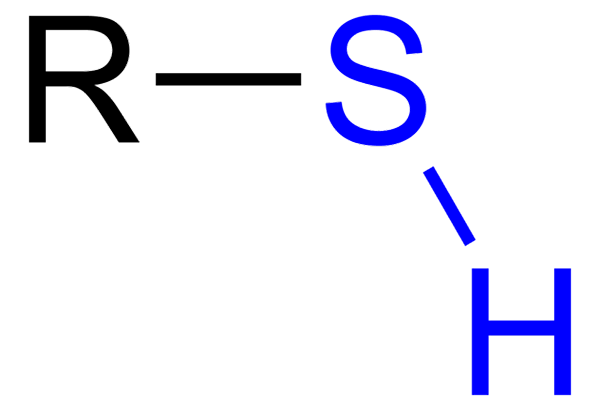
O Tioles Eles são compostos orgânicos que possuem um grupo SH, chamado grupo Tiol ou Sulfi -hidrilo. Sua fórmula geral é RSH, sendo capaz de representar R para um aluguel, um Aryl ou outro grupo químico. A característica distinta dos tiíolos é seu forte cheiro fedorento.
Alguns tiis são usados para transmitir seu cheiro de gases combustíveis, a fim de detectar um vazamento desses gases, que dada sua característica pode ser de grande perigo. Os tioles são semelhantes aos álcoois, pois têm um grupo de OH, enquanto os tiíolos um sh.
 Tiol com grupo azul sulfidrillo
Tiol com grupo azul sulfidrillo No entanto, eles, por sua vez, têm várias diferenças: o grupo OH é mais polar que o grupo SH, e o enxofre é um átomo menor que.
Isso determina que as moléculas de tiíolo não formam ligações de hidrogênio ou água ou entre elas. Portanto, a solubilidade dos tiíolos na água é baixa e seu ponto de ebulição é menor que o dos álcoois com uma cadeia de carbonos semelhantes.
Os tioles são especialmente úteis e frequentes em sistemas bioquímicos, porque vários correspondem a biomoléculas, como a coenzima para. Sua ligação S-H é mais ácida que O-H, mais fácil de quebrar e também mais fácil de substituir ou substituir outros fragmentos moleculares em numerosas síntese orgânica de enxofre.
[TOC]
Propriedades de Tioles
 O aroma fedorento do sopé é composto principalmente de tiíola
O aroma fedorento do sopé é composto principalmente de tiíola Generalidades
O Grupo de Álco do OH e o grupo SH dos Tioles compartilham um conjunto de propriedades físicas e químicas para pertencer a oxigênio e enxofre ao mesmo grupo químico da tabela periódica (via grupo).
Loa -Tioéters, uniocetals e tioéstres, que são análogos a compostos químicos formados por álcoois, como éteres, acetais e ésteres. No entanto, os links S-H e O-H apresentam algumas diferenças que serão refletidas nas propriedades de tiíolo e álcoois.
Cheiro
Uma característica do baixo peso molecular tiíola é seu cheiro desagradável, semelhante ao alho e cebola. Este cheiro é de tanta magnitude que o cheiro humano tem um limiar de uma parte do tiol por dez bilhões de partes do ar.
O etanotiol é adicionado ao gás natural como medida de segurança, para detectar qualquer escape inflamável, mas banheiro. O cheiro de tiíola diminui aumentando o número de carbonos de sua cadeia, porque a volatilidade e a proporção de enxofre tiol diminuem.
Pode atendê -lo: fosfato de amônio: estrutura, propriedades, obtenção, usosPonto de ebulição e solubilidade
O link S-H dos tiíolos tem um momento dipolar menor que o link O-H dos álcoois. Além disso, o átomo de enxofre é uma eletronegatividade cada vez menor que o átomo de oxigênio.
Isso determina que as moléculas de tiis não podem formar ligações de hidrogênio com água ou entre elas, causando uma diferença entre as propriedades físicas de tiíolos e álcoois. Por exemplo: metanotiol (CHO3Sh) tem um ponto de ebulição de 6 ºC, enquanto metanol (CHO3Oh) ferve a 65 ° C.
Portanto, a temperatura ambiente (25 ºC) metanol é um líquido e o metanotiol é um gás.
Em resumo: os tiíolos têm um ponto de ebulição mais baixo do que os álcoois correspondentes apresentados. Pelas mesmas razões, a solubilidade dos tiíolos na água e em outros solventes polares é muito baixa. Enquanto isso, os álcoois de baixo peso molecular são muito solúveis em água.
Reatividade
O link S-H é mais fraco que a ligação O-H; portanto, vincular a S-H se dissocia com mais facilidade, tornando os tióis ácidos fortes do que os álcoois. A maioria dos álcoois tem um PKA entre 16 e 18, enquanto os tiíolos têm um PKA em torno de 11.
Isso permite tiis-): Um agente nucleofílico muito forte.
O grupo SH pode oxidar para formar links de dissulfetos (-S-s-) que estão presentes na oxidação glutatônica: um tiol presente nas células e tem uma função antioxidante.
Bromo ou outros halogênios, bem como oxigênio, podem atuar em um tiol para formar pontes de dissulamento:
2 rsh +br → r-s-s-r '+2 hbr
Os compostos de RSSR são conhecidos como sulfetos orgânicos e alkiiles, r2S.
Por outro lado, agentes oxidantes fortes, como hipoclorito de sódio e peróxido de hidrogênio, podem atuar em tiíola para causar ácidos sulfônicos:
Rsh +h2QUALQUER2 → RSO3H +3 h2QUALQUER
Nomenclatura
A nomenclatura da IUPAC para tiis é muito semelhante à dos álcoois: o nome do alcano do qual o sufixo 'tiol' é adicionado a ele.
Assim, por exemplo, o tistão derivado de Stano é chamado 1-butanotiol, CH3CH2CH2CH2SH, indicando com o número a posição do grupo SH nos carbonos da cadeia.
Pode atendê -lo: cátion: treinamento, diferenças com ânion e exemplosDa mesma forma, há outra nomenclatura, novamente, semelhante à dos álcoois: a palavra 'álcool' é substituída por 'mercaptan' nos nomes dos álcoois. Por exemplo, Cho3Sh, análogo ao álcool metil, ch3Oh, é chamado metil ou mercaptano mercaptano.
Outro exemplo seria Cho3CH2Ch (sh) ch3, chamado 2-butanotiol, comerciante secutílico ou segbutil de mercadorias. Isto é, a ênfase é colocada na identidade de r na fórmula rsh. Portanto, as outras normas de nomenclatura para os álcoois também são cumpridas para tiis.
E, finalmente, quando o grupo SH está presente em uma estrutura maior ou onde predominam os grupos mais importantes, o prefixo sulfi -hidrilo ou mercapto é usado.
Por exemplo, composto ch3CH2Ch (sh) coch3 É chamado 3-Mercapto-2-Penona. Observe que o SH tem menos prioridade do que os grupos oxigenados (exceto o éter), portanto os números menores correspondem a ele.
Síntese
Um método de síntese de tiíolo consiste na reação da tiota com um halogeneto de alquil, que produz um sal intermediário de isotiouron. Isso é hidrolisado por hidróxido de sódio para obter tiol e uréia.
O ch3O SH é preparado industrialmente pela reação de sulfeto de hidrogênio com metanol, na presença de catalisadores ácidos:
CH3Oh +h2S → CH3Sh +h2QUALQUER
Em outro método de produção, um halogeneto de alquil é reagido com hidrosulfuro de sódio:
RX +NASH → RSH +Nax
Formulários
Fixação enzimática ligada a nanopartículas
Os tioles são usados como pontes para se juntar aos complexos de nanopartículas-enzimas em eletrodos de ouro. Por exemplo, os tiíolos são usados para a fixação do complexo nanopartículas-uricasa, uma enzima que intervém na conversão de ácido úrico em alantoine.
Reação tiol -no
É uma reação orgânica entre um tiol e um alceno, chamando uma reação de "clique"; Entre outras características, é uma reação de alto desempenho, amplo escopo, que cria eliminável por -produtos por métodos não -cromatográficos, e isso também é fácil de executar.
A reação tiol -no tem aplicações na síntese de tioazúcar: açúcar presente em salicinol, um inibidor da α -glicosidase. O salicinol foi isolado de plantas usadas no Sri Lanka e na Índia no tratamento do diabetes.
Além disso, a reação tiol -não é usada na química de carboidratos, polimerizações, química da superfície, química de síntese e química dos peptídeos.
Pode atendê -lo: ponto de congelamento: como calculá -lo e exemplosOdorantes
 O gás da cozinha é o banheiro, mas graças à sua composição de tiis de baixo peso molecular, tem um cheiro distinto
O gás da cozinha é o banheiro, mas graças à sua composição de tiis de baixo peso molecular, tem um cheiro distinto Os tiíolos alifáticos de baixo peso molecular são incorporados aos gases naturais, de modo que seu cheiro forte serve como um aviso na face de uma fuga ou vazamento de gás.
Medicamento
Penicilamina (c5HonzeNÃO2S) É um medicamento usado no tratamento da doença de Wilson e artrite reumatóide.
E o captopril (c9HquinzeNÃO3S), por outro lado, é usado no tratamento da hipertensão arterial e em doenças cardíacas congestivas.
Ambos são exemplos de tiíolo com aplicações medicinais.
Biológico
Grupos Tioles estão presentes, entre outros compostos com função biológica, em cisteína, coenzima A e glutationa.
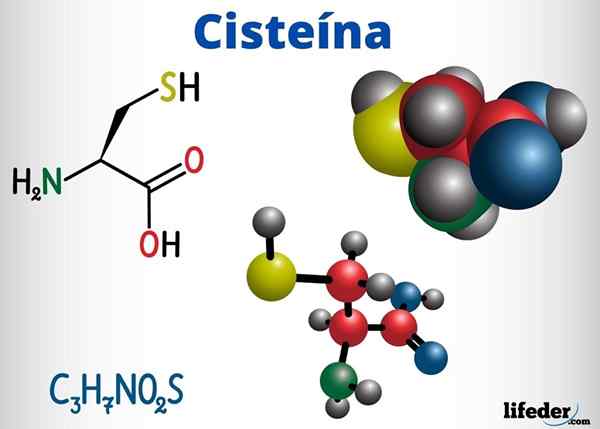
A cisteína é um aminoácido capaz de formar pontes dissulfur em sua cadeia proteica, portanto, responsável pela estrutura terciária de uma proteína. Também pode formar pontes de dissulgação entre diferentes cadeias de proteínas, causando a estrutura quaternária das proteínas.
A cisteína está localizada nos centros ativos de inúmeras enzimas e também possui uma ação antioxidante.
A glutation é uma ação intracelular antioxidante muito importante, conferindo proteção a células e macromoléculas que a compõem.
A coenzima A, por outro lado, é um tiol que intervém na síntese e oxidação de ácidos graxos. Além disso, a coenzima sob a forma de acetilcoenzima A, intervém no início do ciclo do ácido cítrico ou ciclo de Krebs.
Exemplos
Finalmente, alguns nomes dos tiíolos serão listados acompanhados por suas fórmulas moleculares:
-Ácido tioacético (C2H4VOCÊ)
-Coenzima A (cvinte e umH36N7QUALQUER16P3S)
-Glitação reduzida (C10H17N3QUALQUER6S)
-Cisteína (c3H7NÃO2S)
-Mercaptanol (c2H6VOCÊ)
-Metanotiol (cap3Sh)
-1-propanotiol (c3H7Sh)
-Butanotiol (c4H 9Sh)
-Tiofenol ou Tiomerosal (C6H6S)
-Pomelo Mercaptano (C10H18S)
-Hexadecanotiol (c6H3. 4S)
-Penicilamina (c6HonzeNÃO2S)
-Captopril (c9HquinzeNÃO3S)
-Etanotiol (c2H6S)
-2-propenetiol (c3H6S)
-Α-lipóico ou lipoamida (C8H14QUALQUER2S2). É um dissulfeto cíclico.
Referências
- Graham Solomons t.C., Craig b. Fryhle. (2011). Química orgânica. (10º Edição.). Wiley Plus.
- Carey f. (2008). Quimica Organica. (Sexta edição). Mc Graw Hill.
- Morrison e Boyd. (1987). Quimica Organica. (Quinta edição). Addison-Wesley Iberoamericana.
- Wikipedia. (2020). Tiol. Recuperado de: em.Wikipedia.org
- Dr. Dietmar Kennepohl et al. (13 de setembro de 2020). Tióis e sulfetos. Química Librettexts. Recuperado de: química.Librettexts.org
- Os editores da Enyclopaedia Britannica. (2020). Tiol. Recuperado de: Britannica.com
- Nolan MD e Scanlan EM (2020) Aplicações da Chemistry Thiol-Een para ciência peptídica. Frente. Chem. 8: 583272. Doi: 10.3389/FCHEM.2020.583272
- Dr. Carl c. Wamser. (1999). CAPÍTULO 9: Álco do álcool e tióis. Recuperado de: web.Pdx.Edu

