Termoquímica

- 2071
- 452
- Shawn Leffler
Explicamos que é termoquímica, que estudos, suas leis e aplicações
 Na termoquímica, as modificações de calor são estudadas em reações químicas
Na termoquímica, as modificações de calor são estudadas em reações químicas O que é termoquímica?
O Termoquímica É responsável pelo estudo das modificações de calor que são realizadas nas reações entre duas ou mais espécies químicas. É considerado uma parte essencial da termodinâmica, que estuda a transformação do calor e outros tipos de energia para entender a direção em que os processos são desenvolvidos e como sua energia varia.
Também é essencial entender que o calor envolve a transferência de energia térmica que ocorre entre dois corpos, quando estes estão em diferentes temperaturas; Enquanto a energia térmica está associada ao movimento aleatório que átomos e moléculas possuem.
Portanto, como quase todas as reações químicas, a energia é absorvida ou liberada através do calor, a análise dos fenômenos que ocorrem através da termoquímica é muito relevante.
Quais estudos termoquímica?
A termoquímica estuda as mudanças de calor na forma de calor que ocorrem em reações químicas ou quando processos que implicam transformações físicas ocorrem.
Nesse sentido, certos conceitos devem ser esclarecidos dentro do assunto para uma maior compreensão do mesmo.
Sistema
Por exemplo, o termo "sistema" refere -se ao segmento específico do universo que está sendo estudado, sendo entendido como "universo" a consideração do sistema e de seus arredores (tudo externo a isso).
Portanto, um sistema geralmente consiste nas espécies envolvidas nas transformações químicas ou físicas que ocorrem nas reações. Esses sistemas podem ser classificados em três tipos: aberto, fechado e isolado:
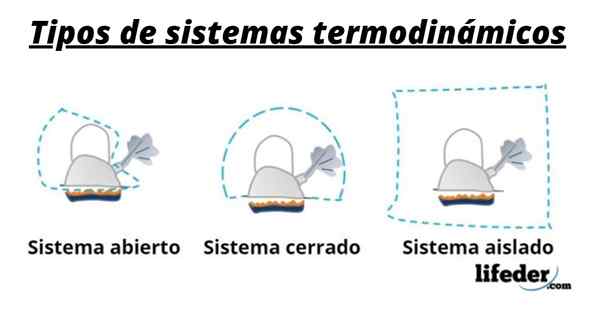
- Um sistema aberto é aquele que permite a transferência de matéria e energia (calor) com seus arredores.
- Em um sistema fechado, há troca de energia, mas não de matéria.
- Em um sistema isolado, a transferência de matéria ou energia na forma de calor não é apresentada. Esses sistemas também são conhecidos como "adiabático".
Leis de Termoquímica
 Germain Hess, criador da lei de Hess, fundamental para a termoquímica
Germain Hess, criador da lei de Hess, fundamental para a termoquímica As leis da termoquímica estão intimamente ligadas à lei de Laplace e Lavoisier, bem como à lei de Hess, que são os precursores da Primeira Lei da Termodinâmica.
O princípio estabelecido pelo francês Antoine Lavoisier (importante químico e nobre) e Pierre-simon Laplace (famoso matemático, físico e astrônomo) revisam que “a alteração na energia que se manifesta em qualquer transformação física ou química tem a mesma e significativa magnitude contrária à alteração na energia da reação reversa ".
Hess Law
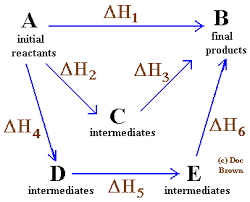
 Diagrama simples e geral, onde a lei de Hess para quatro reações químicas é aplicada
Diagrama simples e geral, onde a lei de Hess para quatro reações químicas é aplicada Na mesma ordem das idéias, a lei formulada pelo químico russo da Suíça, Germain Hess, é uma pedra angular para a explicação da termoquímica.
Esse princípio é baseado em sua interpretação da lei de conservação de energia, que se refere ao fato de que a energia não pode ser criada ou destruída, apenas transformada.
A lei de Hess pode ser promulgada dessa maneira: "A entalpia total em uma reação química é a mesma, se a reação é realizada em uma única etapa como se isso acontecesse em uma sequência de vários passos".
A entalpia total ocorre como a subtração entre a soma da entalpia dos produtos, exceto a soma da entalpia dos reagentes.
No caso de mudança na entalpia padrão de um sistema (em condições padrão de 25 ° C e 1 atm), ela pode ser esquematizada de acordo com a seguinte reação:
Pode atendê -lo: ácido clorogênicoΔHreação = Σδh(produtos) - Σδh(reagentes)
Outra maneira de explicar esse princípio, sabendo que a mudança de entalpia refere -se à mudança de calor nas reações em que são dadas a uma pressão constante, está dizendo que a mudança na entalpia líquida de um sistema não depende do caminho que segue entre o estado inicial e o fim.
Primeira Lei da Termodinâmica
Esta lei está tão intrinsecamente ligada à termoquímica que às vezes é confundida que inspirou o outro; Então, para dar luzes nesta lei, é preciso começar dizendo que ela também tem suas raízes no princípio da conservação de energia.
Para que a termodinâmica não apenas leve em consideração o calor como uma forma de transferência de energia (como a termocímica), mas também envolve outras formas de energia, como energia interna (OU).
Portanto, a variação na energia interna de um sistema (ΔU) é dada pela diferença entre seus estados iniciais e finais (como visto na lei de Hess).
Levando em consideração que a energia interna é composta de energia cinética (movimento das partículas) e energia potencial (interações entre partículas) do mesmo sistema, pode -se deduzir que existem outros fatores que contribuem para o estudo do estado e as propriedades de cada sistema.
Aplicações de termoquímica
A termoquímica possui várias aplicações, algumas delas serão mencionadas abaixo:
- Determinação de alterações de energia em certas reações através do uso de calorimetria (medição de alterações de calor em certos sistemas isolados).
- Dedução de mudanças de entalpia em um sistema, mesmo que elas não possam ser conhecidas por uma medida direta.
- Análise de transferências de calor produzidas experimentalmente quando os compostos organometálicos com metais de transição são formados.
- Estudo das transformações de energia (em calor) dadas em compostos de coordenação de poliaminas com metais.
- Determinação das entalpias da ligação metal-oxigênio de β-DICs e β-DICs unidos para metais.
- Assim como em aplicações anteriores, a termoquímica pode ser usada para determinar um grande número de parâmetros associados a outros tipos de energia ou funções de estado, que são aquelas que definem o status de um sistema em um determinado momento.
- A termoquímica também é usada no estudo de inúmeras propriedades compostas, como em calorimetria de titulação.
Referências
- Wikipedia. (s.F.). Termoquímica. Recuperado de.Wikipedia.org
- Chang, R. (2007). Química, nona edição. México: McGraw-Hill.
- Librettexts. (s.F.). Termoquímica - uma revisão. Obtido da Chem.Librettexts.org
- Tyagi, p. (2006). Termoquímica. Recuperado de livros.Google.co.ir
- Ribeiro, m. PARA. (2012). Termoquímica e suas aplicações para sistemas químicos e bioquímicos. Obtido de livros.Google.co.ir
- Singh, n. B., Das, s. S., E Singh,. K. (2009). Química Física, Volume 2. Recuperado de livros.Google.co.ir

