Teoria orbital molecular

- 2217
- 31
- Mr. Reginald Lindgren
O que é teoria orbital molecular?
O Teoria orbital molecular (Tom) É um modelo matemático desenvolvido para explicar as propriedades físico -químicas das moléculas, como a absorção e emissão de radiação, condutividade elétrica, bem como a natureza eletrônica de seus links. Isso considera, diferentemente da teoria do Link de Valência (TEV), que os elétrons são realocados em toda a molécula, sem estar provavelmente localizado nos links.
Portanto, a teoria orbital molecular aplica os mesmos princípios quânticos que ditam as funções de onda para orbitais atômicos, descrevendo assim o estado energético dos elétrons em átomos; Somente agora, aborda os orbitais moleculares chamados, originados das combinações lineares dos orbitais atômicos dos átomos que estão ligados.
 O paramagnetismo do oxigênio líquido e, portanto, sua atração para ímãs, é explicado graças à teoria orbital molecular. Fonte: Pieter Kuiipeper via Wikipedia.
O paramagnetismo do oxigênio líquido e, portanto, sua atração para ímãs, é explicado graças à teoria orbital molecular. Fonte: Pieter Kuiipeper via Wikipedia. A teoria orbital molecular funciona então, trabalhando com orbitais moleculares, suas distribuições eletrônicas e espaciais, bem como os diagramas de suas respectivas energias, que permitem observar as lacunas de energia que as separam. Acima de tudo, explica o paramagnetismo de certas substâncias, como o oxigênio molecular no estado líquido (veja acima).
O o2, Descrito pelas estruturas de Lewis e pela teoria do vínculo de Valencia, ela tem todos os seus elétrons emparelhados; portanto, em teoria, deve ser diamagnético. No entanto, na prática, foi demonstrado que é realmente paramagnético, ou seja, possui elétrons ausentes; especificamente um par de elétrons ausentes.
A partir da construção do diagrama de OM (orbitais moleculares) para o O2, Uma molécula diatômica homonuclear, pode -se observar que haverá efetivamente dois elétrons ausentes de alta energia. Não apenas isso, mas a rotação e a posição desses elétrons nos OMs também explicam outros estados eletrônicos do ou2 (solteiro).
Outros dos triunfos mais importantes da teoria orbital molecular é que ela ajuda a prever a possível existência de moléculas diatômicas, bem como sua relativa estabilidade. Assim, a teoria orbital molecular está certa na previsão de moléculas como B2 e li2, Mesmo quando eles só podem detectar na fase de vapor em altas temperaturas. Além disso, essa teoria rejeita a existência do hipotético que tenho2 ou ne2.
Tipos de ligações moleculares e orbitais
Assim como a teoria do vínculo de Valência, na teoria orbital molecular, vários tipos de links são considerados dependendo da direcionalidade da sobreposição de orbitais atômicos que participam da ligação química. Entre os mais importantes e presentes na natureza molecular, temos as ligações sigma e Pi.
Sigma
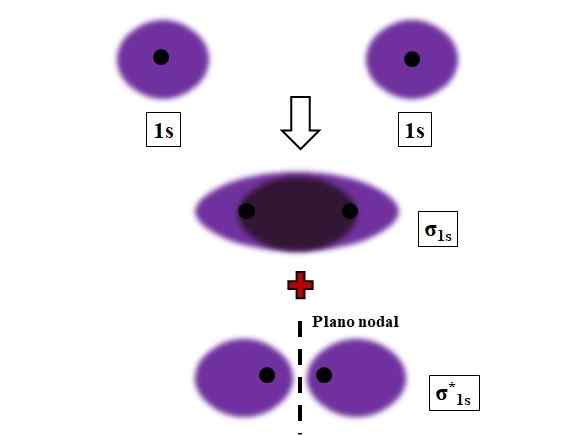 Formação de σ1s e σ1s* liga durante a sobreposição de dois orbitais atômicos 1s. Fonte: Gabriel Bolívar.
Formação de σ1s e σ1s* liga durante a sobreposição de dois orbitais atômicos 1s. Fonte: Gabriel Bolívar. As ligações sigma, σ são estabelecidas quando os orbitais atômicos se sobrepõem frontalmente, em relação a um machado internuclear imaginário.
Considere, por exemplo, o link σ formado quando dois orbitais atômicos 1s, de acordo com um átomo de hidrogênio, estão próximos de uma distância muito curta (imagem acima). Como os orbitais de 1s são simétricos, sua sobreposição sempre será frontal; Portanto, eles sempre gerarão orbitais moleculares σ1s e σ1s*.
Observe agora que o orbital molecular σ1s mostra uma densidade eletrônica concentrada no espaço que separa os dois núcleos. Isso significa que em um orbital σ1s A probabilidade de encontrar um elétron é máximo nesta região da molécula. Os elétrons de σ1s Eles são realocados em todo o espaço que cobre a cor roxa.
Por outro lado, no orbital σ1s* Temos um plano nodal entre os dois núcleos. Isso significa que a probabilidade de encontrar um elétron entre esse espaço é igual a zero. Observe que no orbital σ1s* Os elétrons descrevem posições em torno de cada um dos dois núcleos; não ao redor da molécula como um todo.
Pode atendê -lo: rádio: estrutura, propriedades, usos, obtençãoPi
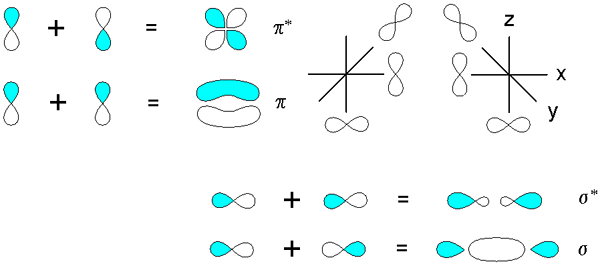 Ligações sigma e pi derivadas da sobreposição de orbitais p. Fonte: V8rik em.Wikipedia, CC BY-SA 3.0, via Wikimedia Commons
Ligações sigma e pi derivadas da sobreposição de orbitais p. Fonte: V8rik em.Wikipedia, CC BY-SA 3.0, via Wikimedia Commons Considere agora as ligações moleculares e orbitais. Isso ocorre quando a sobreposição dos orbitais ocorre em uma direção perpendicular ao eixo internuclear, que é arbitrariamente fixado em qualquer um dos eixos do plano cartesiano. Supondo que estamos falando de um orbital 2px, O orbital 2pe Será livre para estabelecer um link PI (ver lobos azuis e brancos).
Quando dois orbitais 2pe Dois orbitais moleculares originam: π2py e π2py*; O primeiro tem a maior densidade eletrônica e abaixo do eixo internuclear, enquanto o segundo se assemelha a uma flor de quatro cenas, onde a probabilidade de encontrar elétrons é muito menor.
Por outro lado, os orbitais 2p, para dizer 2px, Eles também podem se sobrepor fronteira para originar uma ligação σ e dois orbitais moleculares σ2px e σ2px*. Como nos casos de σ1s e σ1s*, O orbital σ2px mostra maior densidade eletrônica entre os dois núcleos; que é contrário a σ2px*, onde os elétrons são orientados para os lados de fora.
Link
Os orbitais moleculares de lindos são aqueles que contribuem para a estabilidade da molécula. Ou seja, eles devem ter menos energia em comparação com os orbitais atômicos de átomos individuais antes de vincular e formar a molécula. Nesses orbitais, os elétrons são realocados por todas as dimensões da molécula como um todo.
Nos diagramas OM, estes sempre estarão localizados abaixo dos orbitais atômicos que combinados para formá -los. Isso será visto em mais detalhes nas próximas seções.
Anti -hut
Os orbitais moleculares anti -tocros, por outro lado, são aqueles que desestabilizam a molécula. Eles são simbolizados com um asterisco (*), e suas energias são maiores que as dos orbitais atômicos que os originaram. Nestes orbitais, os elétrons são realocados de maneira bastante irregular, como se a molécula fosse fragmentada eletronicamente.
Nos diagramas OM, eles sempre estarão localizados acima dos orbitais atômicos que combinavam para formá -los.
Não ligado
Enquanto isso, orbitais que não vinculam, assim como seus elétrons, são aqueles que não contribuem ou prejudicam a estabilidade da molécula. Suas energias são muito semelhantes às dos orbitais atômicos.
Pedido de link
A ordem do link se torna na teoria do orbital molecular, assim como o número do link está na teoria do vínculo de Valência: uma medida da força do link em uma molécula. Assim, uma ordem de link igual a 1 corresponde a um link simples (-). E um pedido de link (ou.e) igual a 2, corresponde a uma ligação dupla (=). Assim sucessivamente.
Esta ordem é determinada a partir da contagem de elétrons nos diagramas OM para uma molécula específica. Para fazer isso, a seguinte fórmula deve ser aplicada:
qualquer.E = (número de elétrons vinculados - número de elétrons anti -hut)/2
Os elétrons de link contribuem para a molécula para se estabilizar, enquanto os elétrons anti -fiery o desestabilizam. Portanto, quanto mais anti -sung elétrons, menor o ou.E, e a molécula tenderá a ser muito instável. Quando o o.E é igual a 0, significa que a molécula não existe (ou pelo menos em teoria).
Diagramas OM
Nos diagramas de OM, as energias dos orbitais moleculares são representadas e seu recheio eletrônico também é visualizado, o que obedece às regras de Aufbauf e Sinn, bem como o princípio de exclusão de Pauling. Considere, por exemplo, os dois diagramas a seguir:
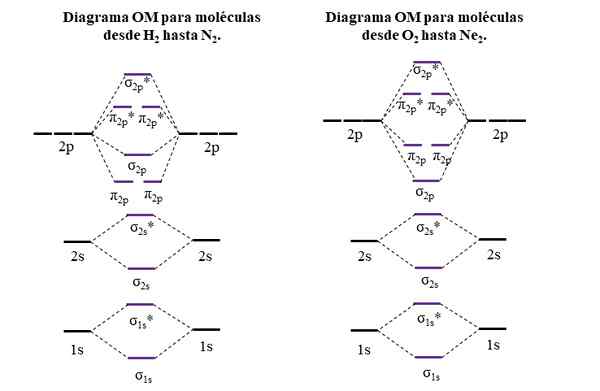 Diagramas OM para moléculas do primeiro e segundo período da tabela periódica. Fonte: Gabriel Bolívar.
Diagramas OM para moléculas do primeiro e segundo período da tabela periódica. Fonte: Gabriel Bolívar. Linhas horizontais nas laterais, pretas, representam as energias dos orbitais atômicos. Em vez disso, linhas horizontais centrais, roxas, são as energias dos orbitais moleculares. Observe como os OMs vinculados e anti -agentes são distribuídos (*) em relação aos orbitais atômicos de átomos individuais.
Pode atendê -lo: um grupo amino (NH2): estrutura, propriedades, exemplosObserve também que no diagrama certo, o OM σ2 p Eles mudam de lugar com π2 p. Isso ocorre com as moléculas de O2, F2, e o hipotético NE2.
Exemplos
Nos exemplos a seguir, o OM prosseguirá com os elétrons, calculará a ordem do link e fará previsões sobre a força do vínculo ou estabilidade da molécula em questão.
H2
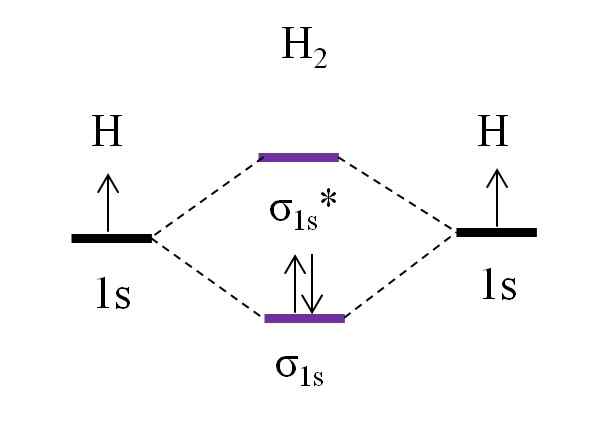 OM Diagrama para molécula de di -hidrogênio. Fonte: Gabriel Bolívar.
OM Diagrama para molécula de di -hidrogênio. Fonte: Gabriel Bolívar. Começando com a molécula mais simples, a do di -hidrogênio, h2, Dois átomos H estão ligados combinando seus dois orbitais atômicos 1s para formar dois orbitais moleculares σ1s e σ1s*. Os dois elétrons prosseguem para preencher os orbitais moleculares.
Primeiro o orbital σ é preenchido1s, Porque é a menor energia (regra de Aufbauf). Então, o segundo elétron deve terminar de encher o orbital σ1s Antes de escalar o orbital σ1s* (Regra de pia). E, finalmente, este segundo elétron guia sua rotação na direção oposta ao primeiro elétron (Princípio de exclusão de Pauling). Assim, os dois elétrons estão localizados no orbital link σ1s.
E a ordem do link? No link orbital molecular σ1s Temos 2 elétrons; Enquanto estava no orbital molecular anti -Hell σ1s* não temos nenhum. Portanto, o cálculo seria:
qualquer.E = (2-0)/2
= 1
Sendo ou.E igual a 1, significa que o link que une os dois átomos de hidrogênio é simples: h-h. Geralmente, se esse valor for igual ou superior a 1, diz -se que a molécula existe e é estável.
Ele2
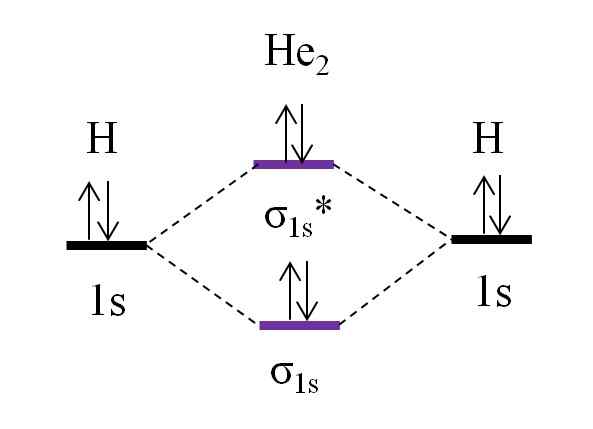 Diagrama OM para molécula hipotética de dihelio. Fonte: Gabriel Bolívar.
Diagrama OM para molécula hipotética de dihelio. Fonte: Gabriel Bolívar. Agora suponha que você tenha a molécula de ele2. Acima, vemos que seu diagrama de om é muito semelhante ao H2, Com 2 elétrons adicionais localizados no orbital σ1s*. Quando há um total de 4 elétrons adicionando os dois átomos, também deve haver 4 elétrons em todos os orbitais moleculares resultantes.
Determinando o O.E para o ele ele2 nós teremos:
qualquer.E = (2-2)/2
= 0
Isso significa que não há link possível de que os dois átomos de hélio. De fato, até o momento a existência dessa molécula não foi identificada, o que concorda com as previsões da teoria orbital molecular.
B2
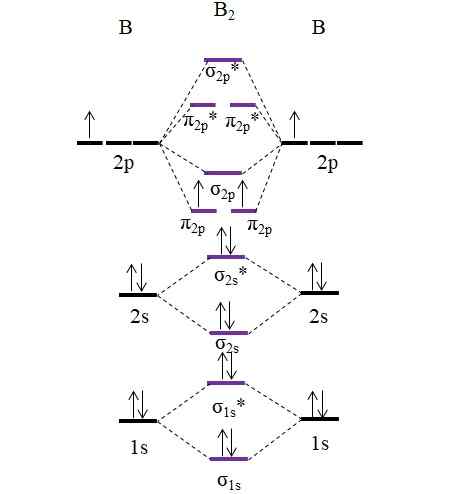 OM Diagrama para a molécula B2. Fonte: Gabriel Bolívar.
OM Diagrama para a molécula B2. Fonte: Gabriel Bolívar. Observe que, na formação de orbitais moleculares, os elétrons das camadas internas também são levadas em consideração; Não apenas os de Valência.
Assim, no exemplo da molécula de Diboro, b2, Cada átomo de boro contribui com 5 elétrons no total, 3 dos quais são de Valência; Estes são os de seus 2s e 2p orbitais. Os dois elétrons dos orbitais 2p estão posicionados em diferentes orbitais moleculares π2 p Com espinhos paralelos (regra de pia).
Em seguida, prosseguimos para calcular a ordem do link:
qualquer.E = (6-4)/2
= 1
Portanto, espera-se que a molécula tenha um link B-B simples. O b2 É uma molécula que só existe no estágio de vapor a temperaturas muito altas, porque o boro em condições normais adota estruturas e desenhos de rede mais complexos.
C2 e C22-
Considere primeiro o diagrama OM para a molécula C2:
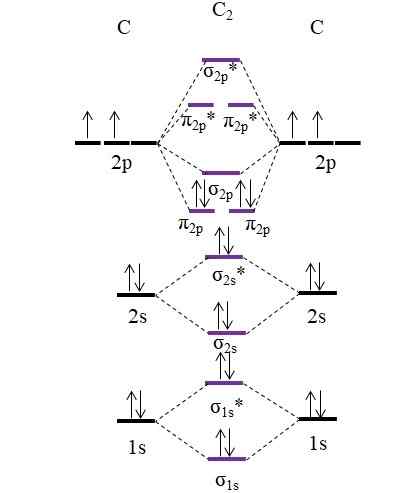 OM Diagrama para molécula C2. Fonte: Gabriel Bolívar.
OM Diagrama para molécula C2. Fonte: Gabriel Bolívar. Agora, os dois novos elétrons fornecidos por átomos de carbono estão posicionados novamente nos orbitais moleculares π2 p Mas com giros opostos (Princípio de exclusão de Pauling).
Determinando seu pedido de link que teremos:
qualquer.E = (8-4)/2
= 2
Observe que os orbitais moleculares π2 p Adicione 4 elétrons ligando à fórmula. Sendo esta ordem igual a 2, significa que a molécula C2 Tem uma ligação dupla, c = c. Novamente, molécula C2, Também chamado de carbono diatômico, há apenas fase a vapor em altas temperaturas e é uma das formas alotrópicas mais simples de carbono.
E quanto a C22-? Seu diagrama OM é o seguinte:
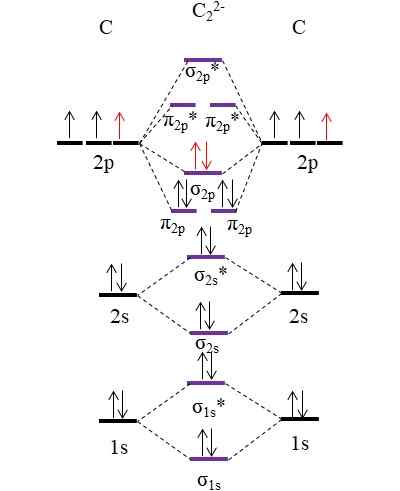 OM Diagrama para o ânion c22-. Fonte: Gabriel Bolívar.
OM Diagrama para o ânion c22-. Fonte: Gabriel Bolívar. Os dois novos elétrons (setas vermelhas) estão posicionadas no orbital molecular de ligação σ2 p. Assim, isso assume que cada átomo de carbono contribui com uma das duas cargas negativas (para um estado de oxidação de -1).
Pode atendê -lo: Mercúrio fulmine: estrutura, propriedades, obtenção, usosCalculando seu pedido de link que teremos:
qualquer.E = (10-4)/2
= 3
Isto é, ânion c22-, Também chamado de ânion acetiluro, possui um link triplo, [c≡C]2-. É um ânion relativamente estável com uma ótima força de ligação; No entanto, dependendo de seus íons de contrapartes, ele pode originar compostos explosivos.
N2 e n2+
A famosa molécula de nitrogênio, n2, Também pode ser descrito perfeitamente usando diagramas orbitais moleculares:
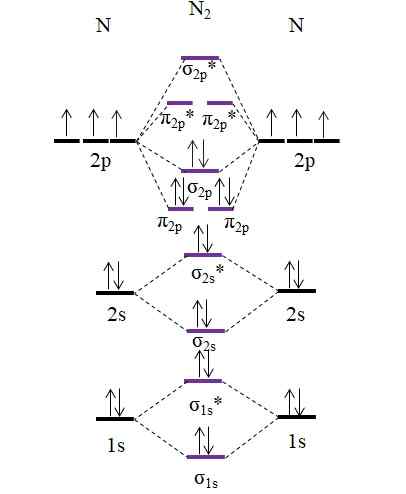 OM Diagrama para a molécula N2. Fonte: Gabriel Bolívar.
OM Diagrama para a molécula N2. Fonte: Gabriel Bolívar. Observe que este diagrama é exatamente o mesmo que para o ânion c22-. Isso significa que n2 e C22- Eles são isoletrônicos. No entanto, esse fato não implica que ambas as espécies se comportem da mesma maneira. Então2, neutro, é muito mais estável que C22-, negativo, mesmo que ambos tenham um pedido de link igual a 3, n≡N.
E quanto a cátion n2+? Vejamos o seu diagrama de om:
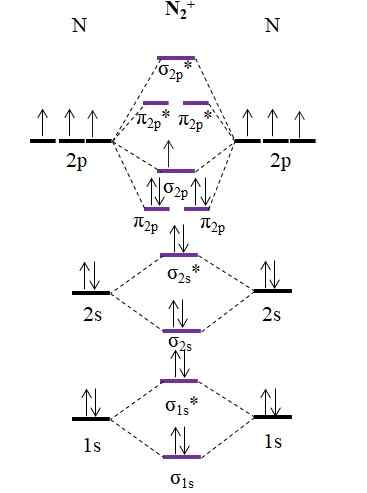 OM Diagrama para Cátion n2+. Fonte: Gabriel Bolívar.
OM Diagrama para Cátion n2+. Fonte: Gabriel Bolívar. Como cátion n2+ Tem um elétron a menos, isso é removido o orbital molecular σ2 p. Então2 É diamagnético, enquanto o n2+ É paramagnético. E sua ordem de link é:
qualquer.E = (9-4)/2
= 2.5
Um link 2 2.5 seria representado com duas linhas e um ponto. No entanto, tal coisa não faz muito sentido na teoria de Valência ou nas estruturas de Lewis. Como esta ordem de link é menor que 3, a força do link presente no n2+ é menor que o n2, Então é mais instável.
QUALQUER2, QUALQUER22- EU22+
Vamos agora ver outra molécula muito importante para a vida: oxigênio molecular ou diatômico, ou2. De acordo com a teoria de Valência e as estruturas de Lewis, ela deve ser diamagnética; Mas experimentalmente demonstrou ser paramagnético, então desapareceu em algum lugar.
Abaixo, comparamos os diagramas om para o O2 e íons ou22- (óxido) e O22+ (Oxidicação):
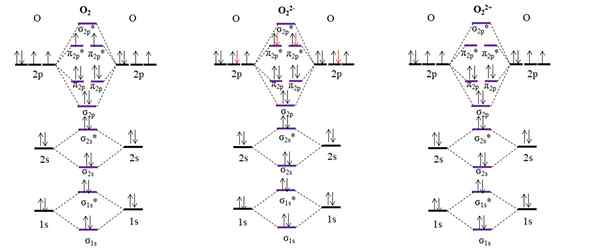 OM diagramas para oxigênio molecular e dois de seus principais íons. Fonte: Gabriel Bolívar.
OM diagramas para oxigênio molecular e dois de seus principais íons. Fonte: Gabriel Bolívar. O diagrama om para o O2 Amostra, diferente dos anteriores, que os orbitais moleculares σ2 p e π2 p mudar sua posição de energia. Além disso, vemos efetivamente que há dois elétrons ausentes nos orbitais π2 p*, que explica o caráter paramagnético do oxigênio (mencionado no início do artigo).
Por outro lado, também temos o diagrama de om para ânion ou22-, Infinitamente se espalhou no cosmos (luas, planetas, cometas, asteróides, etc.). Possui dois elétrons extras (setas vermelhas), que terminam de preencher os orbitais π2 p*, acasalando todos os elétrons. Consequentemente, o ou22- É diamagnético.
Também consideramos o diagrama de om para oxidicação ou22+. Tem dois elétrons a menos que o O2, deixando vazio os orbitais π2 p*. Todos os seus elétrons estão emparelhados e, portanto, é diamagnético.
Link ordens para o O2, QUALQUER22- EU22+ Eles são, respectivamente: 2 (o = o), 1 [o-o]2- e 3 [o bl2+. Portanto, o O22+ teria o link mais forte.
Vantagens e desvantagens
Vantagens
Entre as vantagens da teoria orbital molecular, podemos citar o seguinte:
-Ele permite avaliar ordens de link que o Ordinário não faria muito sentido na teoria do vínculo de Valência
-Ele se correlaciona bem com o diamagnetismo e paramagnetismo de moléculas
-A distância que separa os orbitais moleculares nos diagramas é igual a ΔE e serve para explicar o produto de transições eletrônicas da absorção de fótons
-Aplica -se não apenas para moléculas diatômicas homonucleares, mas também para moléculas heteronucleares, como Co2 e benzeno
-Ele estende seu modelo para outros tipos de compostos, como complexos inorgânicos, por isso suporta a teoria do campo dos ligantes
-A consideração de que os elétrons são realocados em toda a molécula é conveniente para explicar muitas das propriedades físico -químicas
Desvantagens
E entre algumas das desvantagens da teoria orbital molecular que temos, para terminar:
-É muito abstrato e requer um profundo entendimento matemático para entendê -lo completamente
-Diagramas de moleculação como CO2, CO, h2Ou e outros, eles podem ser muito tediosos para elaborar e explicar
-Ele não diz nada sobre regiões ou ligações específicas de uma molécula grande
-Também não fornece nenhuma informação sobre geometria molecular (plano trigonal, plano quadrado, tetraédrico, etc.).
-Não é tão gráfico quanto a teoria do link de Valência
A teoria orbital molecular, em conclusão, é uma teoria que complementa a teoria do vínculo de Valência para ter um panorama mais amplo e mais completo do espectro molecular.
Referências
- Whitten, Davis, Peck e Stanley. (2008). Química. (8ª ed.). Cengage Learning.
- Shiver & Atkins. (2008). Química Inorgânica. (Quarta edição). Mc Graw Hill.
- Wikipedia. (2020). Teoria molecular orbital. Recuperado de: em.Wikipedia.org
- Stephen inferior. (7 de setembro de 2020). Teoria molecular orbital. Química Librettexts. Recuperado de: química.Librettexts.org
- Steven a. Hardinger. (2017). Teoria molecular orbital. Recuperado de: Chemed.Chem.Purdue.Edu
- Pressbooks. (s.F.). Capítulo 8: Teoria Molecular Orbital. Recuperado de: OpenTextBC.AC

