Substâncias puras

- 3170
- 632
- Ernesto Bruen
Definimos o que são substâncias puras, suas propriedades físicas e químicas, que tipos existem e damos vários exemplos.
O que são substâncias puras?
As substâncias puras são todos aqueles que apresentam uma composição química constante e própria. Isto é, eles são homogêneo, Então eles são formados apenas por átomos ou moléculas que aparecem em seus respectivos símbolos ou fórmulas químicas.
Substâncias puras podem ser classificadas como simples (elementos) ou compostos. Eles são simples quando contêm apenas Um único tipo de átomo. São compostos Se eles possuem Dois ou mais átomos diferentes formando moléculas heterogêneas.
Exemplos de substâncias puras simples são ouro (AU), cobre (Cu) ou zinco (Zn). Se encontrarmos outros átomos ou elementos diferentes, eles deixarão de ser puro: ouro misturado com cobre ou cobre misturado com zinco. Portanto, Misturas não são substâncias puras.
Um exemplo de substância pura composta é dióxido de carbono (CO₂), composto por dois átomos de oxigênio e um carbono. Podemos identificar que é uma substância pura porque Você pode escrever sua fórmula.
Água (h₂o) é outro exemplo de substância pura composta. No entanto, deixará de ser puro se adicionarmos açúcar: uma mistura de açúcar e água é uma mistura, não uma substância pura. O mesmo se aplicaria se dissolvemos sais nele.
Propiatas das substâncias puras
Substâncias puras têm uma série de propriedades físicas e químicas:
Homogeneidade
Eles são homogêneos, então você pode dizer que eles têm um Composição constanteE em toda a sua massa ou extensão.
Suponha que tenhamos uma substância pura como ferro (fé). Se dividirmos em pedaços menores de ferro, continuará a ter as mesmas propriedades físicas e químicas.
Pode atendê -lo: propileno (C3H6)Magnitudes constantes de suas propriedades
Tendo um único tipo de átomos ou moléculas Em substâncias puras, suas propriedades físicas ou químicas são muito bem definidas e não apresentam grandes variações. Ou seja, suas propriedades têm magnitudes ou valores constantes na mesma temperatura ou pressão.
Por exemplo: água pura (h₂o) sempre será cristalina e ferverá na mesma temperatura. No entanto, quando misturado com outras substâncias, pode ficar nublado ou mudar de cor. Então suas propriedades começam a ser diferentes: altere a densidade, a viscosidade, o cheiro, a temperatura na qual congela ou ferve, etc.
Diferentes estados físicos
Substâncias puras podem apresentar diferentes estados ou fases físicas, Mantendo sua composição e pureza.
A água destilada é uma substância pura formada apenas por moléculas de H₂o. Ao congelar, ele se transforma em gelo, mas sua composição não muda. O mesmo acontece quando evapora: as moléculas de H₂o permanecem as mesmas.
A água mantém sua pureza nos três estados físicos, a menos que misturados com outros elementos ou compostos.
Descrição por fórmula química
Substâncias puras podem ser descritas perfeitamente com Uma fórmula química.
Por exemplo, a fórmula H₂o descreve a água e sua molécula, para que um tanque de água puro possa ser descrito como H₂o nada mais.
Se adicionarmos sal (NaCl) a este tanque de água pura, teremos uma mistura que não pode mais ser descrita com a fórmula H₂O e, portanto, não é uma substância pura.
Quando uma substância (líquido, sólida ou refrigerante) não pode ser facilmente descrita com uma única fórmula química, então não é pura.
Tipos de substâncias puras
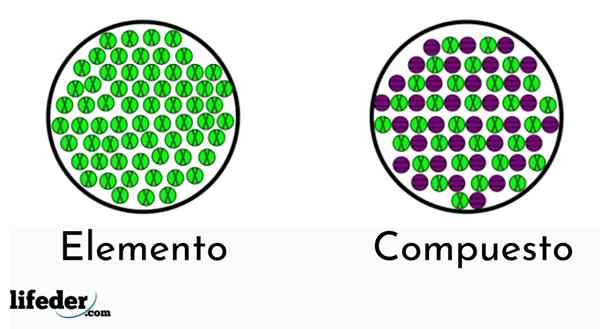 Os elementos têm apenas um tipo de átomo, enquanto os compostos têm mais de um tipo
Os elementos têm apenas um tipo de átomo, enquanto os compostos têm mais de um tipo Existem dois tipos de substâncias puras: os simples (elementos químicos) e compostos químicos.
Pode atendê -lo: carbonato de cálcio: estrutura, propriedades, formação, usosSubstâncias simples (elementos químicos)
Uma substância constituída apenas por Um tipo de átomo correspondente a um elemento químico pode ser considerado como uma substância pura. Isso é para que não haja devida contaminação da presença de átomos de outro elemento químico, ou átomos de vários elementos químicos.
A prata pura (AG) é formada apenas por átomos de metal prateado (AG). Da mesma forma, as peças de níquel (NI) ou metais de cobre (Cu) podem ser considerados substâncias puras, desde que não estejam presentes em suas peças contaminação de outros elementos químicos.
Pelo contrário, as ligas não são substâncias puras, pois resultam da mistura de dois ou mais metais. É por isso que bronze ou latão, por exemplo, não são substâncias puras.
Compostos químicos
Uma substância pura é um composto químico se for constituído por Dois ou mais elementos químicos, que formam moléculas heterogêneas, ou um conjunto de redes iônicas (sais, óxidos, sulfatos, etc.).
Um exemplo de composto químico é a amônia (NH3), formado por três átomos de hidrogênio e um átomo de nitrogênio (NH3). Será uma substância pura se todas as suas moléculas forem do mesmo tipo e tiverem a fórmula NH3. No entanto, se for misturado com oxigênio gasoso ou vapor de água, deixará de ser uma substância pura (será uma mistura gasosa).
Exemplos de substâncias puras
Substâncias puras simples
- Magnésio (mg)
- Cálcio (CA)
- Sódio (NA)
- Ferro (fé)
- TIN (SN)
- Oxigênio gasoso (ou2)
- Helio (ele)
- Mercúrio (HG)
- Cobre (Cu)
- Níquel (NI)
Substâncias puras compostas
- Dióxido de carbono (CO₂).
- Monóxido de carbono (CO).
- Glicose (c6H12QUALQUER6.).
- Ácido cítrico (C6H8QUALQUER7).
- Sulfato de sódio (NA2SW4).
- Hidróxido de sódio (NaOH).
- Água (h₂o).
- Carbonato de sódio (NA2Co3).
- Ácido sulfúrico (H2SW4.).
- Cloreto de sódio (NaCl).
Conselhos para identificar uma substância pura
Se você pode escrever uma fórmula de substância ou é um elemento puro, é uma substância pura.
Assuntos de interesse
Misturas homogêneas
Misturas heterogêneas
Referências
- Helmestine, Anne Marie, Ph.D. Definição de substância pura. Recuperado de: pensamento.com
- CK-12 Foundation et al. Substâncias e misturas puras. Química Librettexts. Recuperado de: química.Librettexts.org


