Estrutura de sulfeto de cobre, propriedades, usa

- 3404
- 980
- Terrell Stokes
Ele sulfeto de cobre É uma família de compostos inorgânicos cuja fórmula química geral é CuxSe. Sim x é maior do que e Isso significa que esse sulfeto é mais rico em cobre do que em enxofre; E se pelo contrário, x É menor que e, Então o sulfeto é mais rico em enxofre do que em cobre.
Na natureza, numerosos minerais que representam fontes naturais desse composto predominam. Quase todos eles são mais ricos em cobre do que em enxofre, e sua composição é expressa e simplificada pela fórmula comxS; aqui x Você pode até tomar valores fracionários, indicativos de um sólido estequiométrico (Cu1.75S, por exemplo).
 Uma amostra de Covellita Mineral, uma das muitas fontes naturais de sulfeto de cobre. Fonte: James St. John [CC por 2.0 (https: // CreativeCommons.Org/licenças/por/2.0)]
Uma amostra de Covellita Mineral, uma das muitas fontes naturais de sulfeto de cobre. Fonte: James St. John [CC por 2.0 (https: // CreativeCommons.Org/licenças/por/2.0)] Embora no estado elementar o enxofre seja amarelo, seus compostos derivados parecem cores escuras; Tal também ocorre com sulfeto de cobre. No entanto, o Covelita Mineral (imagem superior), que é composta principalmente por cus, exibe glitter de metal e uma iridescência azulada.
Eles podem ser preparados a partir de diferentes fontes de cobre e enxofre, usando diferentes técnicas e variando os parâmetros de síntese. Assim, você pode obter nanopartículas de cus com morfologias interessantes.
[TOC]
Estrutura do sulfeto de cobre
Links
Este composto tem a aparência de ser cristalino, para que você possa pensar imediatamente que é composto por íons cu+ (Cobre monovalente), Cu2+ (Cobre divalente), S2- E, mesmo, S2- e s22- (ânions dissulfur), que interagem através de forças eletrostáticas ou vínculo iônico.
No entanto, há um leve caráter covalente entre Cu e S e, portanto, o link Cu-S não pode ser descartado. A partir desse raciocínio, a estrutura cristalina do CUS (e a de todos os seus sólidos derivados) começa a diferir daqueles encontrados ou caracterizados para outros compostos iônicos ou covalentes.
Em outras palavras, não se pode falar sobre íons puros, mas que, no meio de suas atrações (cátion-ânion), há uma ligeira sobreposição de seus orbitais externos (compartilhamento de elétrons).
Coordenações na Covelita
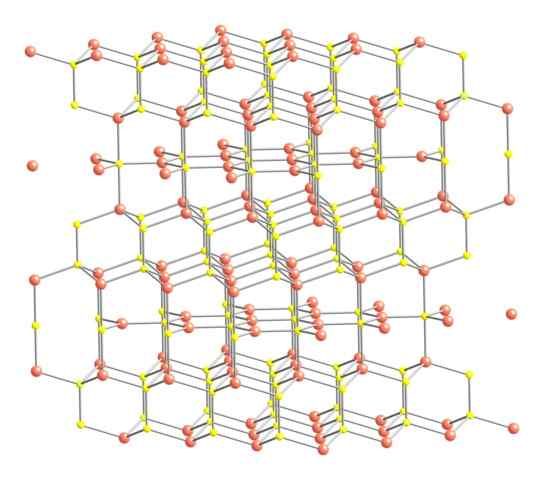 Estrutura cristalina do covellita. Fonte: Benjah-BMM27 [Domínio Público].
Estrutura cristalina do covellita. Fonte: Benjah-BMM27 [Domínio Público]. Dito itens acima, a estrutura cristalina da covelita é mostrada na imagem. Consiste em cristais hexagonais (definidos pelos parâmetros de suas células unitárias), onde os íons se ligam e guiam em diferentes coordenações; Estes são, com um número variado de vizinhos próximos.
Pode atendê -lo: tipo de link de 02Na imagem, os íons de cobre são representados com esferas rosa, enquanto enxofre com esferas amarelas.
Focando a atenção primeiro nas esferas rosa, note -se que alguns estão cercados por três esferas amarelas (coordenação plana trigonal) e outros por quatro (coordenação tetraédrica).
O primeiro tipo de cobre, trigonal, pode ser identificado nos planos perpendicularmente aos rostos hexagonais que eles dão para o leitor, nos quais eles são, por sua vez, o segundo tipo de carbono, tetraédrico.
Atualmente às esferas amarelas, algumas têm cinco esferas rosa (coordenação bipirâmida trigonal) e outras três e uma esfera amarela (novamente, coordenação tetraédrica); Neste último, está antes do ânion dissulfeto, que pode ser visualizado para baixo e dentro da mesma estrutura da covelita:
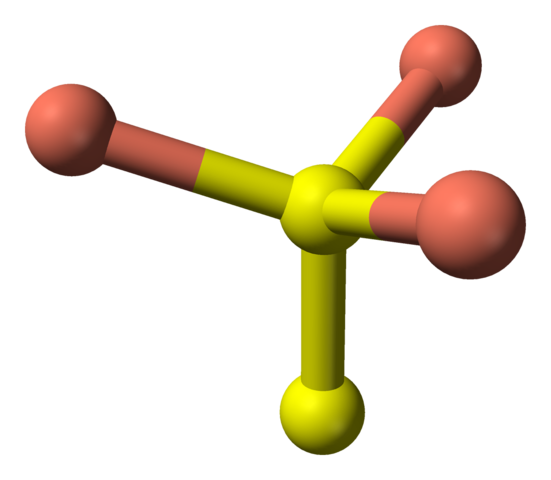 Coordenação tetraédrica do ânion dissulfeto no Covellita. Fonte: Benjah-BMM27 [Domínio Público].
Coordenação tetraédrica do ânion dissulfeto no Covellita. Fonte: Benjah-BMM27 [Domínio Público]. Fórmula alternativa
Existem então íons cu2+, Cu+, S2- e s22-. No entanto, estudos realizados com espectroscopia fotoeletrônica XPS (XPS), eles apontam que todo o cobre é como cátio+; E, portanto, a fórmula do CUS inicial é expressa "melhor" como (Cu+)3(S2−) (S2)-.
Observe que o relacionamento cu: s para a fórmula anterior continua sendo 1, e também as cargas são canceladas.
Outros cristais
Um sulfeto de cobre pode adotar cristais ortorrômbicos, como no polimorfo, γ-Cu2S, do calcocita; cúbico, como em outro polimorfo de calcocito, α-Cu2S; Tetragonal, no mineral de Anilita, Cu1.75S; monoclínico, no Djurleita, CU1.96S, entre outros.
Para cada vidro definido, existe um mineral e, por sua vez, cada mineral tem suas próprias características e propriedades.
Propriedades
Em geral
As propriedades do sulfeto de cobre estão sujeitas ao relacionamento cu: s de seus sólidos. Por exemplo, aqueles que apresentam ânions s22- Eles têm estruturas hexagonais e podem ser semicondutores ou condutores metálicos.
Pode servir a você: fosfato de potássio (K3po4): estrutura, propriedades, usosSe, por outro lado, o teor de enxofre consiste em ânions s2-, Os sulfetos se comportam como semicondutores e também apresentam condutividades iônicas em altas temperaturas. Isso ocorre porque seus íons começam a vibrar e se mover dentro dos cristais, transportando cargas elétricas.
Opticamente, embora também dependa de sua composição de cobre e enxofre, os sulfetos podem ou não absorver a radiação na região infravermelha do espectro eletromagnético. Essas propriedades ópticas e elétricas fazem com que os materiais em potencial sejam implementados em diferentes dispositivos.
Outras variáveis a serem consideradas, além do relacionamento Cu: S, é o tamanho dos cristais. Não é apenas mais "enxofre" ou "cobre" sulfetos de cobre, mas as dimensões de seus cristais transmitem um efeito impreciso em suas propriedades; Assim, os cientistas estão ansiosos para estudar e procurar aplicativos para nanopartículas CuxSe.
Covelita
Cada sulfeto mineral ou de cobre tem propriedades únicas. No entanto, de todos eles, a Covelita é a mais interessante do ponto de vista estrutural e estético (devido à sua iridescência e tons azuis). Portanto, algumas de suas propriedades são mencionadas abaixo.
Massa molar
95.611 g/mol.
Densidade
4,76 g/ml.
Ponto de fusão
500ºC; Mas isso quebra.
Solubilidade em água
3.3 · 10-5 G/100 ml a 18ºC.
Formulários
Nanopartículas em medicina
Não apenas varia o tamanho das partículas até o alcance. Assim, o sulfeto de cobre pode formar nanoesferas, hastes, placas, filmes finos, gaiolas, cabos ou tubos.
Essas partículas e suas atraentes morfologias adquirem aplicações individuais em diferentes terras da medicina.
Por exemplo, nanojaulas ou esferas vazias podem servir como transportadores de drogas no corpo. As nanosferas foram usadas, apoiadas por vidro de carbono e nanotubos de carbono, para servir como detectores de glicose; assim como seus agregados são sensíveis às detecções de biomoléculas, como o DNA.
Pode atendê -lo: 6 indicadores de pH naturais e suas característicasNanotubos CUS excedem nanosferas na detecção de glicose. Além dessas biomoléculas, os imunossensores foram projetados a partir de filmes finos de CUS e certos suportes para detecção patogênica.
Nanocristais e agregados amorfos de CUS podem até causar apoptose de células cancerígenas, sem causar danos a células saudáveis.
Nanociência
Na subseção anterior, foi dito que suas nanopartículas fizeram parte de biossensores e eletrodos. Além de esses usos, cientistas e técnicos também aproveitaram suas propriedades para projetar células solares, capacitores, baterias de lítio e catalisadores para reações orgânicas muito específicas; elementos indispensáveis em nanociência.
Também vale a pena mencionar que, quando eles são suportados em carbono ativado, o conjunto NPCUS-CA (CA: Carbono ativado e NP: nanopartículas) provou servir como um removedor de corantes nocivos para humanos e, portanto, funções como um purificador de fontes de fontes de moléculas indesejadas de absorção de água.
Referências
- Shiver & Atkins. (2008). Química Inorgânica. (Quarta edição). Mc Graw Hill.
- Wikipedia. (2019). Sulfeto de cobre. Recuperado de: em.Wikipedia.org
- Ivan Grozdanov e Methodija Najdoski. (novecentos e noventa e cinco). Propriedades ópticas e elétricas de filmes de sulfeto de cobre de composição variável. Journal of Solid State Chemistry Volume 114, Edição 2, 1 de fevereiro de 1995, páginas 469-475. doi.org/10.1006/JSSC.novecentos e noventa e cinco.1070
- Centro Nacional de Informações sobre Biotecnologia. (2019). Sulfeto de cobre (cus). Banco de dados PubChem. CID = 14831. Recuperado de: pubchem.NCBI.Nlm.NIH.Gov
- Pedro a. Ajibade e Nandipha L. Botha. (2017). Síntese, propriedades ópticas e estruturais
- de nanocristais de sulfeto de cobre de precursores de moléculas únicas. Departamento de Química, Universidade de Fort Hare, Bag Privado X1314, Alice 5700, África do Sul. Nanomateriais, 7, 32.
- Colaboração: autores e editores dos volumes III/17E-17F-41C (s.F.). Sulfetos de cobre (Cu2s, Cu (2-x) s) Estrutura de cristal, parâmetros de latice. In: Madelung ou., Rössler u., Schulz m. (eds) elementos não tetraedralmente ligados e compostos binários i. Landolt-Börnstein-Group III Condensado Matéria (Dados numéricos e relações funcionais em ciência e tecnologia), vol 41c. Springer, Berlim, Heidelberg.
- Momtan, f., VAFAEI, a., Ghaedi, m. et al. Coreano J. Chem. Eng. (2018). Aplicação de nanopartículas de sulfeto de cobre carregadas carbono ativado para adsorção simultânea de corantes termários: Metodologia da superfície de resposta. 35: 1108. doi.org/10.1007/S11814-018-0012-1
- Goel, s., Chen, f., & CAI, W. (2014). Síntese e aplicações biomédicas de nanopartículas de sulfeto de cobre: de sensores a teranósticos. Pequeno (Weinheim An Der Bergstrasse, Alemanha), 10 (4), 631-645. Doi: 10.1002/smll.201301174

