Estrutura de sulfato de manganês (MNSO4), propriedades, obtenção, uso

- 5039
- 1072
- Conrad Schmidt
Ele Sulfato de manganês (II) É um sólido inorgânico formado pelos elementos de manganês (MN), enxofre (s) e oxigênio (O). Sua fórmula química é MSO4. Sua forma anidro (sem água em sua estrutura) é um sólido branco. No entanto, possui várias formas hidratadas e todos eles são sólidos rosa.
O sulfato de manganês em quantidades muito pequenas (minúsculas) é usado como micronutriente para animais e humanos, pois é necessário para o funcionamento normal do organismo.
 Sulfato de manganês Anhidro MNSO4. YOSF0113 na Wikipedia inglesa / domínio público. Fonte: Wikimedia Commons.
Sulfato de manganês Anhidro MNSO4. YOSF0113 na Wikipedia inglesa / domínio público. Fonte: Wikimedia Commons. Também é adicionado junto com certos fertilizantes em solos deficientes em manganês (MN) para culturas agrícolas que precisam, como plantas de uva.
Devido à coloração rosa de suas variedades hidratadas, é usada em pigmentos que servem para pintar cerâmica, tecidos para colorir e outros materiais. Também serve para obter outros compostos de manganês.
Os mons4 deve ser manipulado com cuidado. Sua inalação pode causar problemas respiratórios e produzir sérios inconvenientes no sistema nervoso, que incluem sintomas semelhantes à doença de Parkinson.
Seu excesso também pode causar danos a terras e animais aquáticos e plantas.
[TOC]
Estrutura
O sulfato de manganês anidro (sem água em sua estrutura cristalina) é formado por um íon manganês na oxidação +2, isto é, mn2+ E um ânion sulfato então42-.
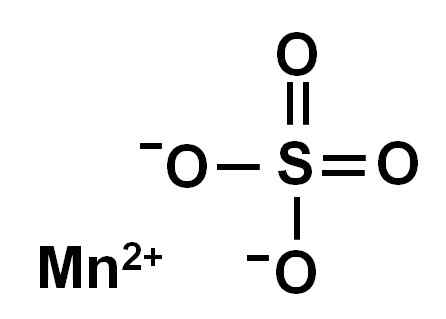 Estrutura química do sulfato de manganês4. Autor: Marilú Stea.
Estrutura química do sulfato de manganês4. Autor: Marilú Stea. Nomenclatura
- Sulfato de manganês (II)
- Monossulfato de manganês
- Sulfato de manganês Anhidro MNSO4
- Manganês manganês sulfato MSSO4 •H2QUALQUER
- Tetra -hidrato de sulfato de manganês MSO4 •4h2QUALQUER
- Sulfato de manganês penta -hidrato4 •5h2QUALQUER
- Sulfato de manganês hepthidratado4 •7h2QUALQUER
Propriedades
Estado físico
Os mons4 anidro (sem água em sua estrutura) é um sólido branco cristalino. No entanto, variedades hidratadas são sólidos rosa ou vermelhos pálidos.
 Manganeso Sulfato tetra -hidrato4.4h2Ou é um sólido rosa. Benjah-BMM27 / Domínio Público. Fonte: Wikimedia Commons.
Manganeso Sulfato tetra -hidrato4.4h2Ou é um sólido rosa. Benjah-BMM27 / Domínio Público. Fonte: Wikimedia Commons. Peso molecular
MSSO4 = 151 g/mol
MSSO4 •H2O = 169,02 g/mol
Ponto de fusão
MSSO anidro4 = 700 ºC
Monohidrato MSO4 •H2O = 400-450 ° C
Menso tetra -hidrato4 •4h2O = 30 ° C
Ponto de ebulição
MSSO anidro4 = Se decompõe a 850 ºC.
Pode atendê -lo: cloreto de cobalto (cocl2 (: estrutura, nomenclatura, propriedadesMenso tetra -hidrato4 •4h2O = 850 ° C
Densidade
MSSO4 = 3,25 g/cm3
MSSO4 •H2O = 2,95 g/cm3
Solubilidade
Muito solúvel em água: 52 g/100 ml de água a 5 ° C. Álcool solúvel. Insolúvel em éter. Ligeiramente solúvel em metanol.
ph
Uma solução de Monse4 •H2Ou 5% tem um pH de 3,7.
Propriedades quimicas
Ao se dissolver na água, o MNSO4 é separado em seus íons Mn2+ Eu sou42-.
O Manganês (II) MN2+ Em solução ácida ou neutra, está ligado a 6 moléculas de água2Ou formando o íon hexaacuomanganese [Mn (H2QUALQUER)6]2+, que é rosa.
O íon hexaacuomanganese [Mn (H2QUALQUER)6]2+ É bastante resistente à oxidação. No meio básico (pH alcalino), esse íon se torna hidróxido de manganês (ii) Mn (OH)2, que é facilmente oxidado, formando compostos de manganês (iii) e manganês (iv).
 Soluções MSSO4 Os ácidos são rosa pela presença do íon hexaacuomanganese [mn (h2QUALQUER)6]2+. Autor: Steve Cross. Fonte: Pixabay.O sulfato de manganês tem várias formas hidratadas, isto é, com água H2Ou em sua estrutura cristalina.
Soluções MSSO4 Os ácidos são rosa pela presença do íon hexaacuomanganese [mn (h2QUALQUER)6]2+. Autor: Steve Cross. Fonte: Pixabay.O sulfato de manganês tem várias formas hidratadas, isto é, com água H2Ou em sua estrutura cristalina.
Estes são monohidratos MSO4 •H2Ou, tetra -hidrato MSO4 •4h2Ou, mnse pentahydrate4 •5h2O e hepthydrate mso4 •7h2QUALQUER. Essas formas hidratadas contêm o íon hexaacuomanganese [Mn (H2QUALQUER)6]2+ Em seus cristais e por esse motivo, eles são sólidos rosa.
O Monohidrato Menso4 •H2Ou é um pouco eflorescente, o que significa que perde parte de sua hidratação água lentamente quando é exposta ao meio ambiente.
Obtenção
Os mons4 pode ser obtido tratando o óxido de manganês (II) MNO, Mn Manghanous Hydroxide (OH)2 o MNNCO de carbonato de manganês (ii)3 Com ácido sulfúrico H2SW4.
MNCO3 + H2SW4 → MSSO4 + H2Ou + co2
Formulários
Como um complemento nutricional
O sulfato de manganês em pequenas quantidades serve certas funções do corpo humano e dos animais.
É por isso que é importante como um composto útil na nutrição e é fornecido como um suplemento alimentar. É usado em traços (quantidades extremamente pequenas).
Quantidades altas podem ser muito tóxicas e prejudiciais.
Em medicina veterinária
Os mons4 Aves coral (galinhas, perus, patos e phaisanes) são administradas para impedir a deficiência ou a falta de elemento manganês nesses animais.
Pode servir você: iodato de potássio (kio3)A falta de manganês se manifesta neles, por exemplo, como a doença chamada Perosia, que é a deformação dos ossos das pernas jovens de pássaros.
 Patitos pode exigir traços de monste4 Em sua dieta para prevenir a perose. Autores: s. Hermann & F. Richter. Fonte: Pixabay.
Patitos pode exigir traços de monste4 Em sua dieta para prevenir a perose. Autores: s. Hermann & F. Richter. Fonte: Pixabay. Aplica -se à alimentação desses pássaros em quantidades ou traços muito pequenos.
Na agricultura
O sulfato de manganês é usado como micronutriente em fertilizantes para videiras (plantas de uva) e tabaco em escadas deficientes em manganês.
No entanto, alguns estudos indicam que o excesso de sulfato de manganês pode inibir ou reduzir a formação de certas enzimas importantes para o crescimento de plantas e seus surtos.
 Em alguns casos, ele se aplica a MNSO4 no chão onde as plantas de uva estão. Autor: Schwoaze. Fonte: Pixabay.
Em alguns casos, ele se aplica a MNSO4 no chão onde as plantas de uva estão. Autor: Schwoaze. Fonte: Pixabay. Por exemplo, verificou -se que é tóxico para algumas culturas como algodão.
Os mons4 Ele também tem uso em fungicidas e, juntamente com certos compostos orgânicos, faz parte de certos pesticidas.
Em várias aplicações
Os mons4 A hidratada é usada por sua coloração para preparar pigmentos inorgânicos que são usados em vernizes vermelhos para cerâmica, em tecidos e outros corantes de materiais.
O sulfato de manganês é usado na fabricação de vidro e os sabonetes também são preparados com ele.
 Alguns telhas de cerâmica podem conter pigmentos de sulfato de manganês. Autor: Dwilliams. Fonte: Pixabay.
Alguns telhas de cerâmica podem conter pigmentos de sulfato de manganês. Autor: Dwilliams. Fonte: Pixabay. Os mons4 É o material de partida para obter o metal de manganês (MN) eletrolicamente, isto é, aplicando eletricidade a soluções aquosas.
Ele também permite que você obtenha dióxido de manganês2 e carbonato de manganês3.
Os mons4 Também é usado para análise química e na formulação de soluções usadas em experimentos de genética com microorganismos.
Riscos
O sulfato de manganês contém o íon manganês (II) (MN2+), que pode ser inofensivo e tóxico, dependendo das quantidades às quais a pessoa, animal ou planta é exposta.
O manganês é essencial para o funcionamento normal do organismo de humanos, animais e algumas plantas. Infelizmente, porém, o manganês também é neurotóxico, ou seja, afeta o sistema nervoso e algumas funções da planta.
Pode atendê -lo: quem projetou o primeiro termômetro moderno?Quantidades aparentemente seguras
Os mons4 Administrado com alimentos em forma de alimento (quantidades extremamente pequenas ou minúsculas) é geralmente segura pela administração de alimentos e medicamentos, ou FDA (sigla para inglês Administração de Alimentos e Medicamentos).
Quantidades perigosas
Exposição prolongada ou repetida a esse composto em quantidades apreciáveis pode causar danos ao ser humano e aos animais.
Produz irritação nos olhos mucosos e nas membranas mucosas do trato respiratório, anorexia, dor de cabeça, perda de equilíbrio, pneumonia e infecções respiratórias.
A inalação crônica causa danos ao sistema nervoso, gerando manghanismo, tremor nas mãos e sintomas típicos da doença de Parkinson.
 O sulfato de manganês afeta o sistema nervoso. Autor: Sabine Zierer. Fonte: Pixabay.
O sulfato de manganês afeta o sistema nervoso. Autor: Sabine Zierer. Fonte: Pixabay. Portanto, a dispersão do pó MSO deve ser evitada4, Use equipamentos de respiração e luvas de proteção.
É tóxico para a vida aquática e, nele, gera efeitos de longo prazo. Deve ser armazenado em locais onde não há acesso ao sistema de drenagem ou esgoto. É muito importante não permitir que seja descartado no ambiente.
Referências
- OU.S. Biblioteca Nacional de Medicina. (2019). Sulfato manganês. Recuperado de PubChem.NCBI.Nlm.NIH.Gov.
- Enciclopédia de química industrial de Ullmann. (1990). QUINTA EDIÇÃO. Volume A22. Vch verlagsgellschaft mbh.
- OU.S. Biblioteca Nacional de Medicina. (2019). Monohidrato de sulfato de manganês. Recuperado de PubChem.NCBI.Nlm.NIH.Gov.
- Algodão, f. Albert e Wilkinson, Geoffrey. (1980). Química inorgânica avançada. Quarta edição. John Wiley & Sons.
- Dunham, m.J. (2010). Guia para Yast Genetics: Genômica Funcional, Proteômica e Outros Sistemas Análise. Formulação média. Em métodos em enzimologia. Recuperado de cientedirect.com.
- Saric, m. e Lucchini, R. (2007). Manganês. Você usa. No Manual sobre a Toxicologia dos Metais (terceira edição). Recuperado de cientedirect.com.
- Vallero, d. (2014). Efeitos neurológicos dos poluentes do ar. Manganês. Em fundos de poluição do ar (quinta edição). Recuperado de cientedirect.com.
- Alegrar. (1986). Em vitro Cultura de Vitis: Os efeitos do sulfato de manganês do espectro da luz e iodeto de potássio na morfogênese. Plant Cell, Tiss and Organ Cult 7: 121-134 (1986). Link recuperado.Springer.com.
- « Estrutura do Secbutil, características, nomenclatura, treinamento
- +125 ditos curtos e populares [com significado] »

