Sulfato de cobre Pentahydrate Estrutura, propriedades, usos

- 4716
- 671
- Ralph Kohler
Ele Sulfato de cobre penta -hidrato É um composto inorgânico formado pelo cobre (Cu), enxofre (s), oxigênio (O) e água (H2QUALQUER). Contém íons de cobre (ii) (Cu2+) e sulfato (então42-). Sua fórmula química é Cuso4 •5h2QUALQUER.
Na natureza, está formando o Chalcantita ou o Calcante Mineral, também chamado Chalclasa ou Calclasa. É um sólido cristalino azul.
 Sulfato de cobre cuso sulfato de cobre4 •5h2QUALQUER. Autor: überraschungsbilder. Fonte: Wikimedia Commons.
Sulfato de cobre cuso sulfato de cobre4 •5h2QUALQUER. Autor: überraschungsbilder. Fonte: Wikimedia Commons. É usado como um complemento nutricional para alguns animais, como ruminantes, porcos e aves. Na agricultura, serve como pesticida. Nas atividades de mineração, permite recuperar outros metais.
Para sua tonalidade azul, serve para a coloração de tecidos e metais. Foi usado para depositar cobre metálico nas fibras de celulose para obter tecidos condutores de eletricidade. Também é usado para preparar nanopartículas de cobre e seus óxidos, com uma variedade de aplicações.
Em altas concentrações, pode ser tóxico para a fauna e a flora; portanto, às vezes é usado para eliminar pragas (animais ou plantas) de ambientes aquáticos, como lagoas e lagoas naturais.
[TOC]
Estrutura
Este composto é formado pelo elemento de cobre em seu estado de oxidação +2 e pelo ânion sulfato. Este último tem um átomo de enxofre com valência +6 cercado por quatro átomos de oxigênio, cada um com valência -2. Dessa maneira, o íon sulfato tem duas cargas negativas.
Ele também tem 5 moléculas de água em sua estrutura. Na figura a seguir, você pode ver a maneira como os vários átomos no vidro são dispostos.
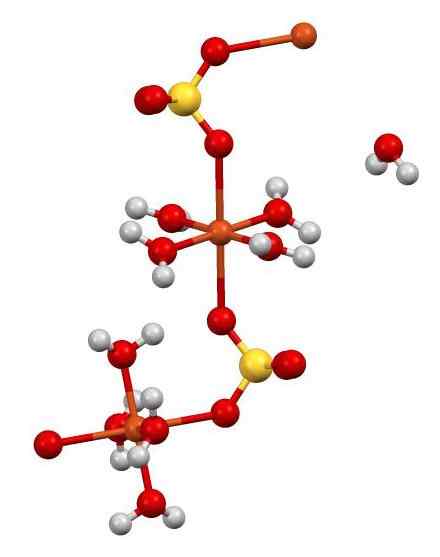 Estrutura de Cuo4 •5h2QUALQUER. Autor: Smokefoot. Fonte: Wikimedia Commons.
Estrutura de Cuo4 •5h2QUALQUER. Autor: Smokefoot. Fonte: Wikimedia Commons. O cu2+ (Esferas de laranja) é coordenado simultaneamente com 4 h moléculas2O (oxigênio = vermelho; hidrogênio = branco) e com 2 átomos de oxigênio do SOS42- (enxofre = amarelo). Na figura um das moléculas H2O está em liberdade aparente, mas faz parte da estrutura cristalina.
Nomenclatura
 Mineral de Chalcantita Cuso4 •5h2QUALQUER. Autor: Archaeodontosaurus. Fonte: Wikimedia Commons.
Mineral de Chalcantita Cuso4 •5h2QUALQUER. Autor: Archaeodontosaurus. Fonte: Wikimedia Commons. - Sulfato de cobre penta -hidrato
- Sofrimento de cobre (ii) penta -hidrato
- Bluejack
- Pedra Azul (inglês Pedra Azul)
- Chalcantita, Calcantita, Chalclasa ou Calclasa
Propriedades
Estado físico
Sólido cristalino azul.
Peso molecular
249.686 g/mol
Ponto de fusão
Ao atingir 110 ºC, ele quebra.
Densidade
2.286 g/cm3
Solubilidade
Solúvel em água: 22,0 g/100 g de água a 25 ° C. Metanol solúvel (escolha3OH). Ligeiramente solúvel em etanol (escolha3CH2OH).
Propriedades quimicas
Este composto ao entrar em contato com a água é dissolvido formando os íons cu2+ Eu sou42-. Sua solubilidade na água diminui significativamente se o ácido sulfúrico estiver presente na água.
Pode atendê -lo: álcool cânia: estrutura, fórmula, propriedades e usosO h2SW4 Fornece tantos íons42- E sua presença gera o efeito de "íon comum", pois esse íon está presente no sulfato de cobre penta -hidrato. A dissolução pode ser expressa da seguinte maneira:
CUSO4 •5h2Ou (sólido) + água ⇔ cu2+ + SW42- + água
Portanto, se o SO já estiver presente na solução42- de ácido sulfúrico, o equilíbrio se move para a esquerda, isto é, para a formação do sólido e, portanto, a solubilidade diminui.
Obtenção
Uma das maneiras de obter sulfato de cobre penta -hidrato é dissolver o mineral malaquita em solução aquosa de ácido sulfúrico (H2SW4) à temperatura controlada. O Malquita contém CU2(OH)2Co3 Com outras impurezas, como ferro.
A solução impura de cobre (ii) é tratada com peróxido de hidrogênio (h2QUALQUER2) garantir que as impurezas de ferro (ii) (fé2+) Torne -se ferro (iii) (fé3+). Este último é feito na forma de hidróxido férrico (fé (OH)3) Usando hidróxido de sódio (NaOH).
Precipitado significa que as partículas de um sólido insolúvel são formadas na solução, que cai no fundo do recipiente que a contém.
 Aparência de uma solução concentrada de CUSO4 •5h2QUALQUER. Autor: Public DomainParturas. Fonte: Pixabay.
Aparência de uma solução concentrada de CUSO4 •5h2QUALQUER. Autor: Public DomainParturas. Fonte: Pixabay. A mistura resultante é filtrada para remover o sólido de fé (OH)3 E o líquido restante é tratado com etanol (c2H5Oh), metanol (escolha3Oh) ou ácido sulfúrico para precipitar todos os íons cu2+ Cuo4 •5h2QUALQUER.
Ao adicionar, por exemplo, etanol, há menos água disponível para íons CU2+ Eu sou42- estão em solução e tendem a se unir. Atua como uma desidratação. Quanto mais etanol é adicionado mais sólido.
O sólido precipitado pode ser recristalizado para purificá -lo. Para fazer isso, ele se dissolve em água a uma temperatura de 80-90 ° C e, em seguida, a solução esfria a 25-30 ° C. O composto penta -hidrato corre novamente e as impurezas permanecem em solução.
Formulários
Tem um amplo intervalo de aplicações comerciais.
Na área da agricultura, serve como pesticida, inseticida, herbicida, fungicida, germicida e aditivo do solo. Nas terapias veterinárias, é usado como anti -helmíntico, fungicida e emético (para causar vômitos).
É usado como pigmento azul ou verde em corantes e corantes, como mordente na cor dos tecidos e metais. Também como um toner de impressão nas fotografias e como reagente para intensificar os negativos.
Pode atendê -lo: carga nuclear eficazÉ usado em atividades de mineração como reagente de flutuação para o zinco e a recuperação de chumbo. Serve para produzir outros compostos de cobre, é usado no bronzeado.
Em comida para animais
Este composto é usado na dieta de porcos em quantidades muito pequenas como promotor de crescimento, especialmente na fase posterior. O mecanismo pelo qual tem esse efeito ainda é desconhecido.
Alguns pesquisadores afirmam que ele reduz a população de bactérias patogênicas ou prejudiciais no intestino dos animais e, consequentemente, favorece seu crescimento.
 Com o cuso4 •5h2O você pode favorecer o desenvolvimento de porcos desmamados. Autor: Mabelamber. Fonte: Pixabay.
Com o cuso4 •5h2O você pode favorecer o desenvolvimento de porcos desmamados. Autor: Mabelamber. Fonte: Pixabay. Outros estudiosos indicam que melhora a saúde do intestino desses animais, mas certas investigações indicam que a injeção intravenosa de cobre também melhora seu crescimento.
Também tem sido usado para o mesmo objetivo em aves e tem sido usado na deficiência de cobre dos ruminantes.
Na síntese de nanopartículas
O sulfato de cobre penta -hidrato tem sido usado para obter nanopartículas mistas de cobre e óxido de cobre (i) (Cu/Cu2QUALQUER).
Nanopartículas são estruturas extremamente pequenas que só podem ser vistas através de um microscópio eletrônico.
Cu/Cu Pow2O Na forma de nanopartículas, utiliza -se em catálise ou aceleração de reações químicas, em semicondutores e em materiais antimicrobianos, entre outras aplicações.
Em estudos para controle de pragas
O cuso4 •5h2Ou tem sido usado em experiências para avaliar sua toxicidade em relação aos caracóis da espécie Pomacea canaliculata.
Estes são moluscos nativos das regiões tropicais da América do Sul que habitam vários tipos de ecossistemas, de pântanos e lagoas a lagos e rios.
Eles são estudados porque alguns parasitas humanos hospedeiros, como o Schistosoma Mansoni (Trematode que produz a doença de BilhaRzia). Caracóis também podem ser prejudiciais às culturas agrícolas de regiões inundadas.
 Caarazonas de Los Caracóis Pomacea canaliculata. H. Zell/CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/3.0). Fonte: Wikimedia Commons.
Caarazonas de Los Caracóis Pomacea canaliculata. H. Zell/CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/3.0). Fonte: Wikimedia Commons.  Ovos depositados pelos caracóis em uma planta aquática. Esses caracóis às vezes constituem uma praga que pode ser controlada com o cuso4 •5h2QUALQUER. Shan LV, Instituto Nacional de Doenças Parasitárias/CC por (https: // CreativeCommons.Org/licenças/por/2.5). Fonte: Wikimedia Commons.
Ovos depositados pelos caracóis em uma planta aquática. Esses caracóis às vezes constituem uma praga que pode ser controlada com o cuso4 •5h2QUALQUER. Shan LV, Instituto Nacional de Doenças Parasitárias/CC por (https: // CreativeCommons.Org/licenças/por/2.5). Fonte: Wikimedia Commons. De acordo com os estudos revisados, as soluções aquosas de sulfato de cobre penta -hidrato são extremamente tóxicas para esses caracóis, para que esse composto possa ser usado para eliminar moluscos de áreas infestadas.
Pode atendê -lo: reações de combustãoDe acordo com certas investigações, isso ocorre porque o caracol não precisa do íon de cobre; portanto, apenas o contato com esse íon seria suficiente para a morte do animal ocorrer.
Em tecidos condutores de eletricidade
Este composto foi usado na obtenção de materiais têxteis com sensores de eletricidade integrados. Esse tipo de tecido possui aplicação em dispositivos de armazenamento de eletricidade, sensores de pressão, fotodetector e telas emissoras de luz.
Para obter tecidos condutores de eletricidade, uma fibra metálica de celulose de tecido chamada "Lyocell" é coberta com cobre metálico. O revestimento é realizado de maneira não eletrolítica com base em uma solução de CUSO4 • 5H2O e outros compostos químicos auxiliares.
 Fibra de Lyocell. Este tipo de tecido foi usado em testes de revestimento de cobre. Dobrozhinetsky/CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/3.0). Fonte: Wikimedia Commons.
Fibra de Lyocell. Este tipo de tecido foi usado em testes de revestimento de cobre. Dobrozhinetsky/CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/3.0). Fonte: Wikimedia Commons. O tecido obtido dessa maneira pode transferir um sinal elétrico, mesmo sob condições de deformação ou alongamento, mantendo a alta condutividade.
Efeitos no meio ambiente
Como explicado acima do CUSO4 •5h2Ou quando se dissolver na água gera o íon de cobre (ii).
Embora o cobre seja essencial em baixas concentrações para atividades celulares de organismos vivos, em altas concentrações, pode ser tóxico e até causar morte.
Portanto, a presença desse íon no ambiente constitui um risco para animais e plantas. Nos ecossistemas aquáticos, pode ser bioacumulado nos seres vivos e na cadeia alimentar, causando danos.
 O cuso4 •5h2O pode ser prejudicial para ambientes aquáticos. Autor: Jamesdemers. Fonte: Pixabay.
O cuso4 •5h2O pode ser prejudicial para ambientes aquáticos. Autor: Jamesdemers. Fonte: Pixabay. De fato, em certas experiências, verificou -se que a contaminação de ambientes aquáticos com sulfato de cobre penta -hidrato faz com que a biomassa de certas plantas aquáticas diminua.
O que significa que as plantas crescem menos na presença desse sal em altas concentrações.
Referências
- Chumbo, d.R. (Editor) (2003). Manual de Química e Física do CRC. 85º CRC Press.
- Kokes, h. et al. (2014). Dissolução de cobre e ferro do minério de malaquita e precisão do sulfato de cobre pentahydrate por processo químico. Ciência e Tecnologia de Engenharia, uma revista internacional. 2014; 17 (1): 39-44. Recuperado de cientedirect.com.
- Azevedo B Alves., J.P. e Peixoto, M.N. (2015). Redução de biomassa de Salvinia irritante Exposto ao sulfato de cobre penta -hidrato (CuO4.5h2QUALQUER). Rev. Ambiente. Água 2015; 10 (3): 520-529. Recuperado de Doaj.org.
- Raiz, w. et al. (2019). Sensor de deformação têxtil flexível com base no tecido de celulose do tipo Lyocell revestido de cobre. Polímeros 2019, 11, 784. MDPI se recuperou.com.
- Pitelli, r.PARA. et al. (2008). Toxicidade aguda de sulfato de cobre e extrato aquoso de folhas de nim seco em caracóis (Pomacea canaliculata). Lei da Sci. Biol. Sci. 2008; 30 (2): 179-184. Recuperado de Doaj.org.
- Badawy, s.M. et al. (2015). Síntese, caracterização e atividade catalítica de nanopartículas de Cu/Cu2O preparadas em meio aquoso. Boletim de engenharia e catálise química de reação química. 2015; 10 (2): 169-174. Recuperado de Doaj.org.
- Justel, f.J. et al (2014). Solubilidades e propriedades físicas de soluções saturadas no sulfato de cobre + ácido sulfúrico + água do mar em diferentes temperaturas. Jornal brasileiro de engenharia química. 2015; 32 (3): 629-635. Recuperado de Doaj.org.
- Parque, c.S. e Kim, B.G. (2016). Em vitro Solubilidade do sulfato de cobre (II) e tri -hidróxido de cloreto de dicopper para porcos. Austalas asiáticas. J. Anim. Sci. 2016; 29 (11): 1608-1615. Recuperado de Doaj.org.
- OU.S. Biblioteca Nacional de Medicina. (2019). Sulfato de cobre penta -hidrato. Recuperado de PubChem.NCBI.Nlm.NIH.Gov.
- Wikipedia (2020). Chalcanthite. Recuperado de.Wikipedia.org.
- « Características de biomas marinhos, tipos, flora, fauna
- Estrutura de ceras (biológicas), propriedades, função, tipos »

