Sulfato de cálcio (case4) Estrutura química, propriedades, usos
- 3529
- 423
- Gilbert Franecki
O que é sulfato de cálcio?
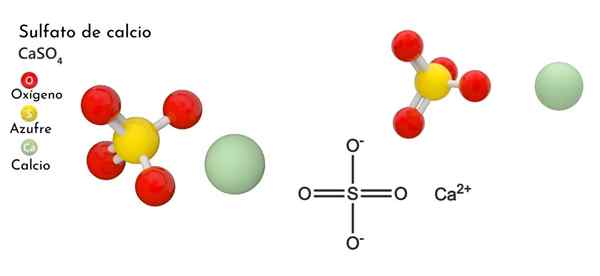
Ele Sulfato de Calcio É um sal ternário de cálcio, alcalino -metal (MR. Scholambara), enxofre e oxigênio. Sua fórmula química é caso4, O que significa que para cada cátion CA2+ há um ânion então42- interagindo com isso. Constitui um composto com ampla distribuição na natureza.
Suas formas mais abundantes são o caso4· 2h2Ou (o gesso) e o caso de forma anidra4 (O hidrita). Há também uma terceira forma: o gesso ou gesso de Paris, produzido pelo aquecimento do gesso (a hemidrato, caso4· 1/2h2QUALQUER).
O sulfato de cálcio é um composto muito útil no trabalho do ser humano, pois é usado em inúmeras funções que incluem construção de estradas, embelezamento doméstico e até reparo ósseo.
Estrutura química do sulfato de cálcio

Na imagem superior, a célula unitária Ortorrombic é mostrada para o caso4. Aqui é assumido que as interações são puramente eletrostáticas; isto é, que cátions2+ Eles atraem ânions tetraédrico então42-.
No entanto, o CA2+ É altamente propenso a coordenar, formando estruturas poliédricas ao seu redor. A que se deve? À disponibilidade eletrônica de cálcio para aceitar elétrons de espécies básicas ou negativas (como os átomos de O SO42-).
Considerando o ponto anterior, agora os íons Ca2+ Eles aceitam links dativos (fornecidos pelo O) e a célula unitária é transformada, conforme indicado pela imagem inferior:
Consequentemente, o poliedro Cao é formado8 (A esfera verde de CA2+ cercado por oito esferas vermelhas de ou tetraedra assim4 fechar). Poliedros de cálcio e sulfato tetraedra; Esta é a estrutura cristalina do caso4 anidro.
Pode servir a você: Bipe Beraral: O que é, características, para que éAlém disso, quando os cristais são hidratados com o sal di -hidratado ou a hemidrato (caixa4· 1/2 h2O)- A estrutura está atrasada para incorporar moléculas de água.
Essas moléculas podem ser intercaladas e coordenadas com o cálcio; isto é, eles substituem um ou dois grupos de sulfato.
Por outro lado, nem toda a água continua para integrar o CAO Polyedro8. Alguns, por outro lado, formam pontes de hidrogênio com sulfatos. Eles servem como união para duas seções em zigue -zague, produtos do arranjo de íons no vidro.
Propriedades do sulfato de cálcio
 Aparência do sulfato de cálcio
Aparência do sulfato de cálcio Fórmula molecular
Case4 · NH2O.
Peso molecular anidro
136.134 g/mol.
Cheiro
É o banheiro.
Aspecto
No caso de anidrita, parece um pó sólido ortorrérômbico ou monoclínico branco. Os cristais são de uma cor variável: eles podem ser brancos ou com um corante azulado, acinzentado ou avermelhado; Também pode ser vermelho de tijolo.
Densidade
2,96 gr/cm3 (forma anidra). 2,32 gr/cm3 (formulário de di -hidrato).
Ponto de fusão
1450 ºC (2840 ºF). Característica das fortes interações eletrostáticas entre os íons divalentes CA2+ Eu sou42-.
Solubilidade
0,2-0,3 % em água a 25 ° C. É pouco solúvel em água e insolúvel em etanol.
Estabilidade
Estável à temperatura ambiente.
Usos do sulfato de cálcio
Em construção e arte
É usado na elaboração do estuque para frisar as paredes das casas e outras construções que contribuem para seu embelezamento. Além disso, os moldes de mídia são feitos nos telhados e quadros das janelas. O gesso também está nos céus Rush.
O sulfato de cálcio é usado para ajudar a resolver o problema que ocorre na hidratação do concreto, colaborando assim na construção de estradas, avenidas, etc.
Pode servir a você: eletrofilo: reações, exemplos, eletrofilidadeCom o gesso, as esculturas são elaboradas, especialmente figuras religiosas, e nos cemitérios que são usados nas lápides.
Terapêutica
Veterinario
Experimentalmente, peças estéreis de sulfato de cálcio foram usadas no veterinário para reparar defeitos ósseos ou cavidades, como os deixados por feridas ou tumores.
O gesso ou o gesso de Paris pode ser usado para reparar defeitos ósseos por sua capacidade única de estimular a osteogênese. Medronato de Raio X e Techecium (TC99M).
Uma regeneração óssea foi demonstrada em seis cães em um período de 4 a 6 meses. O sulfato de cálcio começou a ser usado neste campo em 1957, na forma de comprimidos de gesso de Paris, sendo capaz de preencher ossos de cachorro.
A substituição óssea do sulfato de cálcio é comparável à observada no osso autogênico.
Ruhaimi (2001) aplicou sulfato de cálcio em um osso da mandíbula de coelho recém -destruído, observando um aumento na osteogênese e calcificação óssea.
Medicamento
O sulfato de cálcio é usado em medicina para imobilizar as articulações que sofreram luxações e em ossos fraturados, além de serem usados como um excipiente na elaboração de comprimidos.
odontologia
Na odontologia, é usado como base para elaborar as próteses dentárias, em restaurações e impressões dos dentes.
Na elaboração de alimentos
É usado como coagulante na elaboração do tofu, um alimento feito com soja e de grande consumo nos países do leste como um substituto de carne. Além disso, tem sido usado como um alimento reafirmante e no tratamento de farinhas.
Pode atendê -lo: AlotropyComo fertilizante e condicionador de solos cultivados
O gesso (caso4· 2h2O) foi usado como fertilizante na Europa desde os 18.
O cálcio deve estar disponível para raízes de plantas para suprimento adequado. Então, a adição de cálcio melhora as culturas de horticultura e amendoim (amendoim).
A podridão das raízes de amendoim produzida por patógenos biológicos, bem como a podridão apical da melancia e do tomate, são parcialmente controlados com as aplicações de gesso agrícola.
O gesso ajuda a reduzir a dispersão de argila, causando a formação de crostas no chão. Ao reduzir as crostas formadas no chão, o gesso facilita a saída das mudas. Também aumenta a entrada de ar e água no chão.
O gesso ajuda a melhorar o solo mitigando a acidez e a toxicidade do alumínio, adaptando assim a colheita para solos de sódio.
Na produção de outros compostos
Sulfato de cálcio reage com bicarbonato de amônio para formar sulfato de amônio. Também tem sido usado no processo de produção de ácido sulfúrico.
O sulfato de cálcio ashidro é misturado com xisto ou magro e, quando a mistura é aquecida, o trióxido de enxofre é liberado. Óxido de enxofre é um precursor de ácido sulfúrico.