Solvatação
- 1634
- 127
- Tim Mann
Qual é a solvatação?
O Solvatação É a união física e química entre partículas de soluto e solvente em uma solução. Difere do conceito de solubilidade no fato de que não há equilíbrio termodinâmico entre uma sólida e suas partículas dissolvidas.
Essa união é responsável pelos sólidos dissolvidos "desaparecem" em vista dos espectadores; Quando, na realidade, as partículas ficam muito pequenas e acabam "embrulhadas" por moléculas de solvente, o que os torna impossíveis de observá -las.

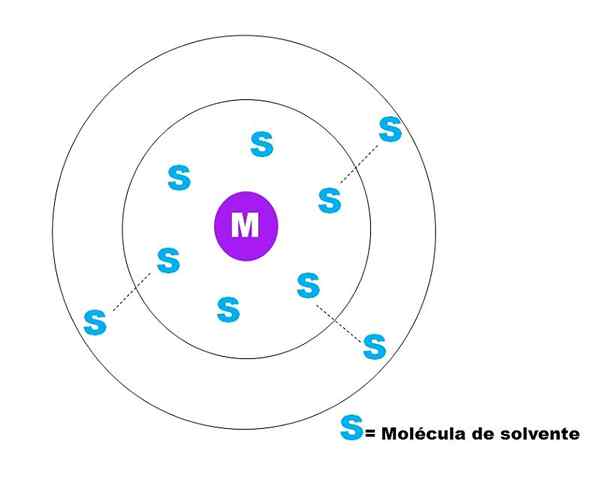
Na imagem superior, um esboço muito geral da solvatação de uma partícula m é representado. M pode estar bem (M+) ou uma molécula; E S é a molécula de solvente, que pode ser qualquer composto no estado líquido (embora também possa ser gás).
Observe que M está cercado por seis s, que compõem o que é conhecido como Esfera de solvatação primária. Outras moléculas M a uma distância mais alta interagirem por Van der Waals forças com a primeira, formando uma esfera de solucionamento secundário, e assim por diante até que qualquer pedido seja evidente.
Processo de solvatação
 Fonte: Gabriel Bolívar
Fonte: Gabriel Bolívar Molecularmente, como está o processo de solvatação? A imagem superior resume as etapas necessárias.
As moléculas de solvente, azuis, são inicialmente ordenadas a interagir entre si (s-s); E as partículas (íons ou moléculas) de soluto, roxo, fazem o mesmo com interações m-m fortes ou fracas.
Para que a solvatação ocorra, o solvente e o soluto devem expandir (Segunda seta preta) para permitir interações soluto-solvente (M-S).
Isso implica necessariamente uma diminuição nas interações soluto-solvente e solvente; diminuir que requer energia e, portanto, este primeiro passo é endotérmico.
Uma vez que o soluto e o solvente se expandiram molecularmente, misturam e trocam lugares no espaço. Cada círculo roxo da segunda imagem pode ser comparado ao da primeira imagem.
Pode atendê -lo: cálcio: propriedades, estrutura, obtenção, usaUma mudança no grau de ordenação das partículas pode ser detalhada na imagem; ordenado no começo e bagunçado no final. Como conseqüência, o último passo é exotérmico, uma vez que a formação das novas interações estabiliza todas as partículas da solução.
Aspectos energéticos
Por trás do processo de solvatação, existem muitos aspectos energéticos que devem ser levados em consideração. Primeiro: as interações S-S, M-M e M-S.
Quando as interações M-S, ou seja, entre o soluto e o solvente, elas são muito superiores (fortes e estáveis) em comparação com as dos componentes individuais, se fala de um processo de solutação exotérmica; E, portanto, a energia é liberada para o ambiente, que pode ser verificada medindo o aumento da temperatura com um termômetro.
Se, pelo contrário, as interações M-M e S-S forem mais fortes que os M-S, então "expandir" precisará de mais energia do que a que eles ganham quando a solvatação culminar.
Fala -se então sobre um processo de solutação endotérmica. Sendo esse caso, há uma diminuição da temperatura, ou o que é o mesmo, os arredores esfriam.
Existem dois fatores fundamentais que decidem se um soluto se dissolve ou não em um solvente. O primeiro é a mudança de solução de dissolução (ΔHDis), Como explicado, e o segundo é a mudança de entropia (ΔS) entre o soluto e o soluto dissolvido. Geralmente, δs está associado ao aumento do distúrbio também mencionado acima.
Interações intermoleculares
Foi mencionado que a solvatação é o resultado da união física e química entre o soluto e o solvente; No entanto, como exatamente são essas interações ou sindicatos?
Se o soluto é um íon, m+, As chamadas interações ion-dipolo são produzidas (M+-S); E se for uma molécula, haverá interações dipolo-dipolo ou forças de dispersão de Londres.
Pode atendê -lo: ciclohexano: estrutura, usos, conformaçõesAo falar sobre interações dipolo-dipolo, diz-se que há um momento de dipolo permanente em M e S. Assim, a região rica em elétrons Δ- de m interage com a região pobre do elétron Δ+ de s. O resultado de todas essas interações é a formação de várias esferas de solvatação em torno de M.
Além disso, existem outros tipos de interações: a coordenada. Aqui, as moléculas dos links de coordenação de S (ou dativos) com m, formando várias geometrias.
Uma regra fundamental para memorizar e prever a afinidade entre o soluto e o solvente é: O igual dissolve igual. Portanto, as substâncias polares se dissolvem com grande facilidade em solventes igualmente polares; e substâncias apolares, dissolver -se em solventes apolares.
Diferenças entre solvatação e hidratação
 Fonte: Gabriel Bolívar
Fonte: Gabriel Bolívar Como a solução de hidratação é diferente? Os dois processos idênticos, exceto porque os s, da primeira imagem, são substituídos pelos da água, H-O-H.
Na imagem superior, você pode ver um cátion m+ cercado por seis moléculas H2QUALQUER. Observe que os átomos de oxigênio (vermelho) são direcionados para carga positiva, porque é o mais eletronegativo e, portanto, possui a maior densidade negativa δ-.
Por trás da primeira esfera de hidratação, outras moléculas de água são agrupadas por pontes de hidrogênio (oh2-Oh2). Estas são interações do tipo ion-dipolo. No entanto, as moléculas de água também podem formar ligações de coordenação com o centro positivo, especialmente se for metálico.
Assim, o famoso aquocomplejos, m (oh2)n. Como n = 6 na imagem, as seis moléculas são orientadas em torno de M em um octaedro da coordenação (a esfera interna da hidratação). Dependendo do tamanho de M+, A magnitude de sua carga e sua disponibilidade eletrônica, disse que a esfera pode ser menor ou maior.
Pode atendê -lo: óxido cromo (iii): estrutura, nomenclatura, propriedades, usosA água é talvez o solvente mais surpreendente de todos: dissolve uma quantidade imensurável de solutos, é um solvente muito polar e tem uma constante dielétrica anormalmente alta (78.5 k).
Exemplos de solucionamento
Abaixo estão três exemplos de solvatação na água.
Cloreto de cálcio
Ao dissolver o cloreto de cálcio na água, o calor é liberado quando os cátions são resolvidos2+ e CLIONS-. O CA2+ É cercado por várias moléculas de água igual ou superior a seis (Ca2+-Oh2).
Além disso, o CL- É cercado por átomos de hidrogênio, a região Δ+ da água (Cl--H2QUALQUER). O calor liberado pode ser usado para massas de gelo derretendo.
Uréia
No caso da uréia, é uma molécula orgânica com estrutura H2N-co-NH2. Ao resolver, moléculas H2O Formulário de pontes de hidrogênio com os dois grupos de aming (-NH2-Oh2) e com o grupo carbonil (c = o- h2QUALQUER). Essas interações são responsáveis por sua grande solubilidade na água.
Além disso, sua dissolução é endotérmica, ou seja, esfria o recipiente de água onde é adicionado.
Nitrato de amônio
O nitrato de amônio, como a uréia, é um soluto que esfria a dissolução após a solvatação de seus íons. O NH4+ Solvata de maneira semelhante a CA2+, Embora provavelmente porque seja a geometria tetraédrica possui menos moléculas H2Ou ao seu redor; E não3- Solvata da mesma maneira que os CLIONS- (Oh2-QUALQUER2Não h2QUALQUER).
Referências
- Whitten, Davis, Peck e Stanley. Química. (8ª ed.). Cengage Learning.
- Belford r. (s.F.). Processos de solvatação. Química Librettexts. Recuperado de: química.Librettexts.org
- Surf Guppy. (s.F.). O processo de solvatação. Recuperado de: Surfgupy.com

