Soluções químicas
- 2482
- 648
- Gilbert Franecki
Explicamos quais soluções químicas, suas características, os tipos que existem e damos vários exemplos são
 Um produto químico é uma mistura homogênea entre duas substâncias
Um produto químico é uma mistura homogênea entre duas substâncias O que são soluções químicas?
As Soluções químicas São misturas homogêneas entre um solvente e um ou mais solutos. As soluções mais simples são formadas por um único soluto e um solvente, como quando dissolvemos o açúcar na água, mas existem soluções que podem se tornar muito complexas com centenas de solutos.
As soluções mais comuns estão em estado líquido e, na maioria dos casos, o solvente é água. Por esse motivo, a água é geralmente chamada de "o solvente universal". Mas as soluções não se limitam a líquidos, uma vez que existem soluções em um estado gasoso e sólido.
O soluto também pode ser encontrado em diferentes estados. Por exemplo, soluções líquidas com solutos sólidos (como sal), fluidos (como álcool) ou gasosos (como gás carbônico em refrigerantes) podem ter soluções sólidas).
Como reconhecer o soluto e o solvente?
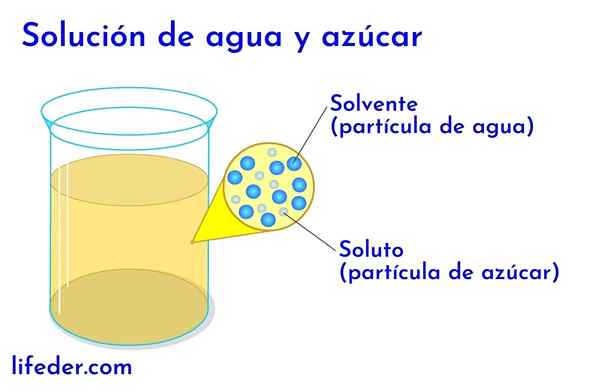
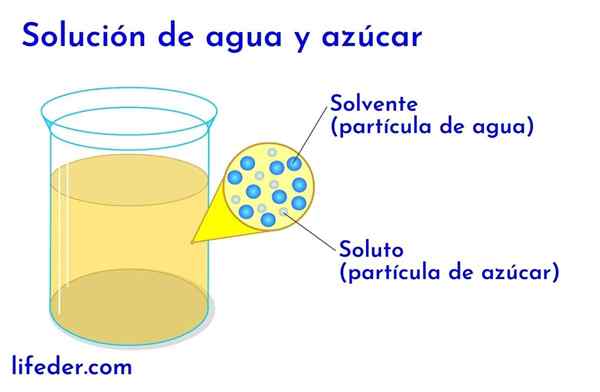 Soluto e solvente em água com açúcar
Soluto e solvente em água com açúcar Em qualquer solução em que há água, este é considerado o solvente. Em todos os outros casos, o solvente corresponde ao componente que está em maior quantidade ou em maior proporção e quase sempre é um líquido. Os outros componentes presentes na solução são considerados solutos.
Vejamos dois exemplos:
- Em uma solução de água e açúcar, a água é o solvente e o açúcar no soluto.
- O álcool isopropílico que compramos na farmácia é uma solução formada por água e álcool. Nesta solução, o solvente é água, apesar de estar em uma proporção menor que o álcool.
Características e propriedades de soluções químicas
São misturas homogêneas
As soluções são misturas nas quais o soluto solvente não pode ser distinguido, a olho nu ou com o uso de uma lupa ou um microscópio.
Eles têm composição uniforme
Isso significa que qualquer parte de uma solução sempre terá os mesmos componentes (soluto e solvente) para a mesma concentração.
Pode atendê -lo: cádmio (CD): história, propriedades, estrutura, usosEles são caracterizados por sua concentração
A concentração é uma das características mais importantes de uma solução, pois determina muitas de suas propriedades.
Eles são translúcidos (transparentes)
As soluções líquidas devem ser translúcidas, ou seja, a luz deve ser capaz de cruzá -las sem dispersar.
Eles são estáveis
Uma solução em que o soluto e o solvente não reagem entre si serão estáveis indefinidamente. Isso significa que não sofrerá nenhuma mudança ao longo do tempo, desde que sua composição permaneça constante (o solvente não evaporará, por exemplo).
Suas propriedades físicas e químicas são diferentes das do solvente
As propriedades físicas e químicas do solvente mudam ao misturar com o soluto. Por exemplo, as soluções têm um ponto de ebulição maior, um ponto de fusão mais baixo e também com alta pressão osmótica em comparação com o solvente puro.
Eles podem ser separados através de alguns processos físicos e químicos
As soluções não podem ser separadas por filtração, centrifugação ou decantação. Eles só podem ser separados por métodos físicos ou químicos, como cristalização, destilação, evaporação, osmose reversa e cromatografia, entre outros.
 Instrumentos de destilação
Instrumentos de destilação Tipos de soluções químicas
As soluções químicas podem ser classificadas de acordo com sua concentração, de acordo com sua condição física e de acordo com a natureza do solvente:
De acordo com sua concentração
- Soluções insaturadas: Eles são aqueles em que o soluto ainda não atingiu sua concentração máxima no solvente. Por esse motivo, mais soluto pode ser dissolvido para preparar uma solução mais concentrada.
- Soluções saturadas: São soluções nas quais o solvente não pode mais dissolver mais soluto. Nesses casos, sempre há uma parte do soluto sem se dissolver. Por exemplo, se adicionarmos muito sal a um copo com água, parte desse sal não se dissolverá e permanecerá no fundo do copo.
- Soluções superaturadas: Estas são soluções nas quais há mais soluto dissolvido do que o solvente admite. Isso pode ser conseguido aquecendo uma solução saturada para dissolver ainda mais soluto e depois deixar esfriar lentamente até a temperatura inicial. Essas soluções são instáveis, pois qualquer distúrbio como vibração ou uma pequena partícula de poeira na superfície pode causar a separação do excesso de soluto.
De acordo com sua condição física
- Soluções líquidas: Eles são os mais comuns. Nesse tipo de soluções, o solvente é um líquido (como água, álcool, óleo, etc.) Mas o soluto pode ser encontrado em qualquer estado (sólido, líquido ou gás). Alguns exemplos de soluções líquidas são água salgada, vinho e refrigerantes.
- Soluções sólidas: Nesses casos, tanto o solvente quanto o soluto estão em estado sólido. Os exemplos mais comuns desse tipo de soluções são ligas de metal, como bronze, aço e latão, mas também existem outros exemplos, como vidro.
- Soluções gasosas: Como o nome indica, eles são misturas homogêneas nas quais todos os componentes estão em um estado gasoso.
De acordo com o solvente
- Soluções aquosas: Se em uma solução o solvente é água, é dito que é uma solução aquosa. Essas são as soluções mais comuns que podem ser encontradas na vida cotidiana.
- Soluções alcoólicas: O solvente mais comum, após a água, é álcool. Entre os álcoois mais comuns estão metanol, etanol e álcool isopropílico.
- Soluções em outros solventes orgânicos: Existem muitos outros compostos orgânicos que são usados como solventes. Isso inclui alguns alcaneos, a maioria dos éteres, cetonas líquidas e outras.
Exemplos de soluções químicas
Limonada
É uma solução aquosa formada pela água como solvente e suco de limão e açúcar como solutos.
Água do mar
Água do mar ou água salgada é uma solução aquosa composta de água e uma mistura de sais. Entre esses sais, o que é a maior proporção é o cloreto de sódio (NaCl) conhecido como sal de mesa comum.
Pode atendê -lo: óxido de mercúrio (HG2O)Xarope concentrado
Esta é uma solução aquosa quase saturada com água de açúcar.
Água com gás
A água carbonatada, também conhecida como refrigerante, é uma solução aquosa de dióxido de carbono gasoso (CO2) Na água.
Ar
O ar é uma solução gasosa na qual o nitrogênio pode ser considerado como solvente e oxigênio e outros gases como solutos.
Manteiga clarificada
Ao derreter a manteiga e remover toda a espuma, uma solução amarela transparente chamada manteiga clarificada é obtida. Esta é uma solução em que o solvente e os solutos são gordos.
Vidro colorido
O vidro colorido são soluções de estado sólido, nas quais o solvente é sílica fundida e os solutos são outros minerais que fornecem ao vidro sua cor característica.
Café
Esta é uma solução aquosa complexa que contém muitos solutos (entre eles a cafeína) que dão à bebida seu aroma e sabor característicos.
O aço
O aço é uma liga ou solução sólida formada por ferro metálico e carbono de grafite.
Plasma sanguíneo
O plasma sanguíneo é uma solução obtida após centrifugando o sangue para remover todas as células e outros sólidos suspensos. Esta é uma solução aquosa bastante concentrada que contém centenas de solutos, incluindo carboidratos, aminoácidos, proteínas solúveis e eletrólitos, entre outros.
Referências
- Chang, R. e Goldsby, k. (2014). Química. 11ª ed. Nova York: Educação McGraw-Hill.
- Solução (25 de janeiro de 2021). Na Wikipedia.org.
- Brown, t. eu., Lemay, e. (2018). Química: a ciência central. 14ª edição. Pearson.
- Krestonosich, s., e outros. (1992). Soluções. Editorial Miró.
- Vidal, J. PARA. (Editor) (1997). Mentor Interativo - Enciclopédia Temática do Estudante. Editorial do Oceano. Barcelona.

