Composição, tipos e exemplos de soluções cristalóides
- 755
- 184
- Alfred Kub
As Soluções cristalóides Eles são aqueles formados pela dissolução de um eletrólito e outras pequenas moléculas solúveis em água, usadas em procedimentos de rotina clínica, como ajustar o volume do fluido do sistema circulatório. Em termos químicos simples: essas soluções nada mais são do que soluções de mineração aquosas e diluídas.
As soluções cristalóides desempenham um papel importante nas terapias clínicas, como infusões intravenosas, fluidos para casos de hemorragia, desidratação, hipovolemia e infecções. Geralmente, sua concentração salina é isotônica, o que significa que o número de seus íons dissolvidos é comparável ao do plasma sanguíneo.
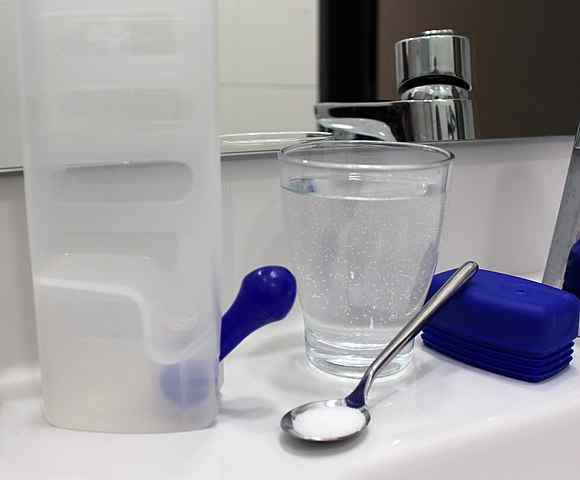
 Uma solução cristalóide pode ser preparada simplesmente dissolvendo sal e outros solutos na água em uma concentração moderada. Fonte: Rillke/CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/3.0)
Uma solução cristalóide pode ser preparada simplesmente dissolvendo sal e outros solutos na água em uma concentração moderada. Fonte: Rillke/CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/3.0) As soluções cristalóides, portanto, não causam alterações osmóticas, mas fornecem volume adequado de líquido para que o sangue continue a irrigar pelo sistema circulatório. Dessa maneira, é alcançado que o coração bombeia o sangue diluído e pode fornecer oxigênio aos tecidos.
Um exemplo de uma solução cristalóide é a solução salina normal, que contém NaCl a uma concentração de 0,9%. No entanto, dependendo do caso clínico, outras soluções podem ser escolhidas, com diferentes componentes, concentrações e tipos de tonicidade.
[TOC]
Composição de soluções cristalóides
Todas. Caso contrário, eles não poderiam se integrar saudáveis ao nosso corpo e causar qualquer reação indesejável. Como uma solução ou solução, também possui solutos, que em essência são sais minerais ou eletrólitos fortes.
As vendas podem ser várias, desde que contribuam em concentrações moderadas, os íons Na+, AC2+, K+ e cl-. Além de sais inorgânicos, eles também podem ter solutos orgânicos muito solúveis em água, como acetatos, gluconatos e lactatos. Além disso, algumas dessas soluções contêm glicose (dextrose).
Pode atendê -lo: hidroxiapatitaAs concentrações desses sais ou solutos são muito variadas e são expressas em porcentagens, miligramas por decilitadores (mg/dl), molaridades ou osmolaridades. A escolha de um ou de outro dependerá dos critérios clínicos.
Pessoal
Foi dito no início que as soluções cristalóides são frequentemente usadas para fornecer volume de líquido ao sistema circulatório. No processo, dependendo de sua tonicidade, sofre de plasma sanguíneo ou mudanças não -osmóticas, que promovem ou favorecem certos estados desejados no paciente.
Assim, a única coisa que distingue uma solução cristalóide de outra não é a natureza química de seu soluto, mas sua tonicidade; isto é, se for uma solução hipertônica, isotônica ou hipotônica.
Hipertônico
Uma solução cristalóide hipertônica é aquela cuja concentração salina é superior à encontrada no plasma sanguíneo. Portanto, a água migra de dentro das células para o plasma que aumentou sua tonicidade devido à presença da solução cristalóide hipertônica. Um exemplo desse tipo de solução é o de 3% de NaCl, principalmente mais concentrado que a solução salina normal a 0,9%.
Essas soluções são contra -indicadas para a maioria dos casos clínicos, exceto para aqueles que apresentam sequelas neurológicas.
Isotônico
Uma solução isotônica de cristalóides é aquela cuja concentração salina é comparável ou idêntica à do plasma sanguíneo e do interior celular. Portanto, não há troca de água entre os dois meios. Um exemplo desse tipo de solução é 0,9%NaCl, já mencionado acima.
Hipotônico
E, finalmente, uma solução cristalóide hipotônica é aquela cuja concentração salina é menor que a do plasma sanguíneo e o compartimento ou espaço intracelular. Desta vez, a água se move para o interior da célula até atingir o equilíbrio. Um exemplo desse tipo de solução é 0,45% naCl.
Pode servir a você: metais alcalinotherrososAssim como nas soluções cristalóides hipertônicas, os hipotônicos são contra -indicados para a maioria dos casos clínicos, especialmente para aqueles em que existe um risco de edema cerebral.
Exemplos de soluções cristalóides
Alguns exemplos de soluções cristalóides serão mencionados e descritos abaixo. A diferença entre um e a outra estará na identidade de seus eletrólitos ou sais dissolvidos.
Solução salina normal
A solução salina normal possui uma composição de NaCl a 0,9%, é isotônica e também é a solução cristalóide mais recorrente, pois serve para tratar infinitos de casos de desidratação comuns; como os causados por diarréia, choque, vômito, sangramento, entre outros. No entanto, o uso em pacientes com problemas renais ou cardíacos é evitado.
Solução de lactato
Também conhecida como solução de Ringer ou Hartmann (embora eles diferem ligeiramente em suas concentrações iônicas), é uma que é composta por uma mistura de cloreto de sódio, lactato de sódio, cloreto de cálcio e cloreto de potássio.
Sua composição salina é a que se assemelha à do plasma sanguíneo, por isso é tipo isotônico. É usado como fluido ou fluido de ajustador para casos de queimaduras, traumas, desequilíbrio eletrolítico, acidose metabólica. No entanto, é contra -indicado para pacientes que sofrem de hipercalcemia.
O lactato é metabolizado em nosso corpo e acaba se transformando em bicarbonato. Esta solução também pode conter ânion de gliconato, bem como certas quantidades de magnésio, mg2+.
Solução de glicose
Também conhecida como solução cristalóide de dextrose, ela vem em duas concentrações: 5 e 10% (D5 ou D10, respectivamente). Isso é inicialmente hipotônico, mas é transformado em isotônico quando a glicose é absorvida, fornecendo água para os rins. Embora forneça uma quantidade significativa de calorias, é contra -indicado para pacientes que sofrem de hiperglicemia.
Pode atendê -lo: ácido Elagic: estrutura, propriedades, obtenção, localização, usaAo contrário de outras soluções cristalóides, essas são doces. Os mais doces têm concentrações superiores a 10% (D20, D30, D50, etc.), E eles são destinados a pacientes com edema pulmonar e cerebral. Por outro lado, eles reduzem o catabolismo de proteínas, protegem o fígado e ajudam a combater o colapso circulatório.
Soluções salinas hipertônicas e hipotônicas
As soluções salinas hipertônicas (3 e 5% de NaCl) são usadas para fornecer líquido a pacientes queimando, induzem hiperosmolaridade e aliviam as insuficiências renais. Por outro lado, soluções salinas hipotônicas (0,45% de NaCl ou concentrações mais baixas), controle de hipernatremia e são contra -indicadas para queimar pacientes.
Portanto, um fornece os efeitos contrários ao outro; Quando a solução hipertônica é indispensável, o hipotônico é reprovado e vice -versa.
O mecanismo por trás de todas as soluções cristalóides é baseado no equilíbrio osmótico e hídrico entre fluidos intra e extracelulares.
Referências
- Lewis Sr et al. (3 de agosto de 2018). Colóides ou cristalóides para substituição de fluidos em pessoas criticamente. A colaboração de Cochrane. Recuperado de: Cochrane.org
- Epstein Em, Waseem M. (29 de novembro de 2019). Fluidos cristalóides. In: Statpearls. Treasure Island (FL): Statpearls Publishing 2020 -. Recuperado de: NCBI.Nlm.NIH.Gov
- Wikipedia. (2020). Expansor de volume. Recuperado de: em.Wikipedia.org
- Elsevier b.V. (2020). Cristalóide. Cientedirect. Recuperado de: ScientEdirect.com
- Sheila Bouie. (2020). Cristalóides: Definição e Exemplo. Estudar. Recuperado de: estudo.com

