Solução hipertônica
- 3721
- 683
- Melvin Mueller
Explicamos o que são soluções hipertônicas, suas características, quais são o uso, as diferenças com o hipotônico e dão vários exemplos
Muitos ficarão surpresos ao saber que a maneira como as plantas absorvem a água através de suas raízes e a maneira como os dedos das mãos estão enrugados ao tomar banho na água do mar, estão intimamente relacionados.
Ambas as coisas acontecem graças à existência de uma membrana que funciona como um filtro e uma solução hipertônica que literalmente suga água através dele. Mas o que é uma solução hipertônica?
Neste artigo, essa pergunta será respondida e as características mais relevantes das soluções hipertônicas também serão apresentadas, para que são, como são distinguidas de outros tipos de soluções e alguns exemplos do mesmo.
O que é uma solução hipertônica?
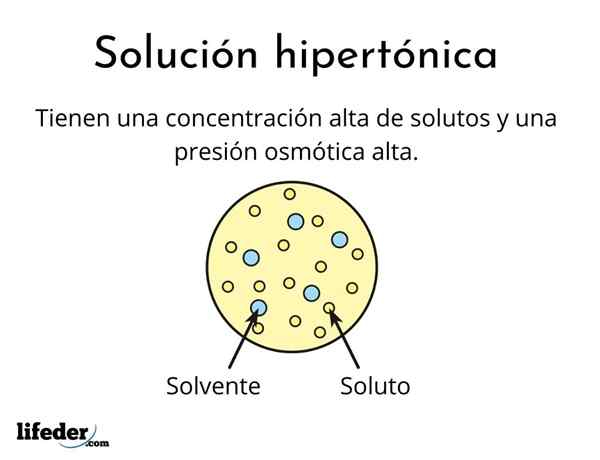
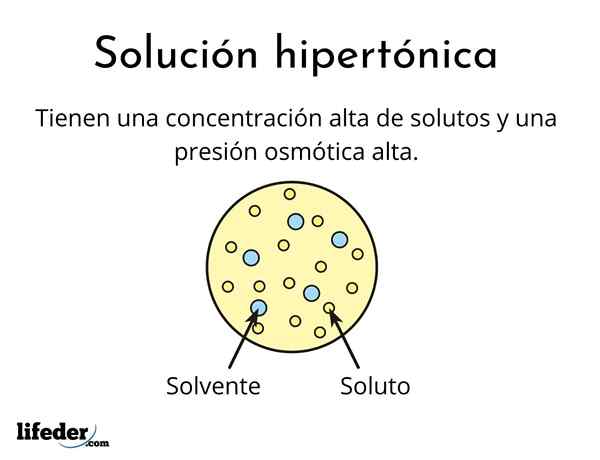
A solução hipertônica É aquele que contém uma concentração total de solutos osmolaramente ativos maiores que a de outra solução de referência. Osmolares ativos significa que os solutos não podem atravessar um tipo especial de membrana (semelhante a um tecido) que atua como um filtro ou filtro, ou seja, que a água passe, e não para as partículas de soluto.
Essa alta concentração de solutos faz com que as soluções hipertônicas tenham alta pressão osmótica. Essa pressão é o que praticamente suga a água através da membrana, que é chamada de osmose.
A palavra hipertônica vem do prefixo grego Hyper-, que significa "ativado ou acima" e "tons", o que significa tensão ou pressão, então hipertônico significa literalmente "que ela tem maior pressão ou tensão".
É importante ter em mente que, na biologia e na medicina, desde que se fale de solução hipertônica, refere -se a uma solução mais concentrada do que a solução contida no sangue, que é chamada de plasma sanguíneo.
Características de soluções hipertônicas
As soluções hipertônicas têm algumas características básicas:
Eles são formados por um solvente e pelo menos um soluto
Nenhuma solução pode ser hipertônica, mesmo assim é muito concentrada. O soluto deve ser incapaz de atravessar a membrana, enquanto a água deve ser capaz de passar sem problemas, caso contrário, a pressão osmótica não é gerada.
Eles têm altas concentrações de solutos
É isso que os torna soluções hipertônicas. Como mencionado há um momento, as soluções hipertônicas estão mais concentradas que o sangue.
Pode servir a você: Destilação fracionária: processo, equipamentos, aplicações, exemplosEles podem ter composições diferentes
Uma solução hipertônica pode conter um único soluto como sal, ou pode conter uma mistura de solutos como sais e açúcares, por exemplo.
Os solutos podem ser iônicos, neutros ou ambos
As vendas contêm íons com cargas elétricas que não os deixam atravessar a membrana, então são pequenas. Outros solutos não têm íons, mas são grandes e gordos e não se encaixam nos buracos.
Eles têm alta pressão osmótica
Como mencionado acima, as soluções hipertônicas têm uma pressão osmótica maior que o sangue.
Eles podem desidratar células
Soluções hipertônicas extraem a água das células, deixando -as como passas. É por isso que nossas mãos e pés estão enrugados quando tomamos banho na praia.
Quais são as soluções hipertônicas para?
As soluções hipertônicas têm muitos usos na vida cotidiana e também em medicina. Alguns dos usos mais comuns são:
Eles são usados para manter a comida
- Exemplo: os pêssegos em xarope não apodrecem porque o xarope tem muito açúcar dissolvido e é uma solução muito hipertônica. Ao desidratar células, as soluções hipertônicas não permitem fungos e bactérias em alimentos, porque morrem de sede. Isso permite que os alimentos durem mais.
Eles servem para reduzir a inflamação
- Exemplo: quando alguém sofre um acidente e atinge a cabeça, há muitas vezes uma inflamação no cérebro. Para curar o paciente, os médicos injetam uma solução de salão de 7,5%. Esta solução praticamente suga água, reduzindo a inflamação no cérebro.
Eles servem para substituir os eletrólitos.
- Exemplo: O sódio é um eletrólito que precisamos viver e, quando um paciente tem pouco sódio no sangue, uma solução salina de 7,5% é injetada para reabastecer o sódio que foi perdido.
Eles são usados para comida parenteral
- Exemplo: quando as pessoas não podem comer pela boca ou através de um tubo, elas alimentam uma solução hipertônica que contém um tipo de açúcar chamado glicose.
Diferenças com soluções hipotônicas e isotônicas
Assim como existem soluções hipertônicas, também existem soluções hipotônicas e isotônicas. A diferença entre as soluções últimos e hipertônicas é sua concentração. As soluções hipotônicas são aquelas que são menos concentradas que o sangue, e isotônico têm a mesma concentração que o sangue.
Por exemplo, água pura, pois não tem nada soluto, é hipotônica, enquanto a água de coco tem sais e açúcares com uma concentração quase igual à do sangue, por isso é isotônico.
Além de diferenciar sua concentração, as soluções hiper, hipo e isotônicas diferem na maneira como eles afetam as células.
A imagem a seguir mostra o efeito dos diferentes tipos de soluções nos glóbulos vermelhos (as células pequenas que tornam o sangue vermelho).
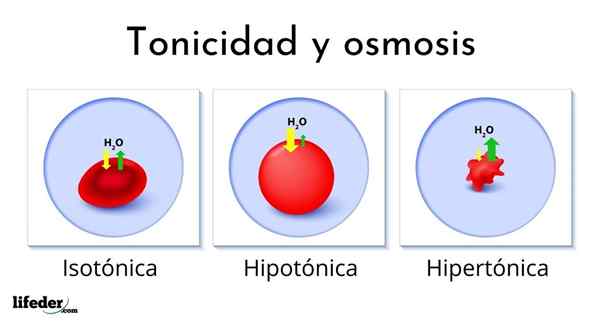
Se os glóbulos vermelhos forem introduzidos em uma solução hipertônica, ele extrai a água, desidratando -os e deixando -os enrugados como uma passagem.
Por outro. Finalmente, se eles forem introduzidos em uma solução isotônica, a água dentro e fora dos glóbulos vermelhos estará em equilíbrio para que nada aconteça.
Exemplos de soluções hipertônicas
Melaço de cana
 Pêssegos em xarope
Pêssegos em xarope O xarope em que os pêssegos e outras frutas são preservados contém concentrações muito altas de açúcar, por isso é uma solução hipertônica.
A salmoura
A salmoura é uma solução de água e sal com concentrações muito altas entre 3,5% e 25%, o que pode se tornar quase 30 vezes mais concentrado que o sangue (ou seja, é muito hipertônico).
O vinagre
Um vinagre comum é uma solução hipertônica, pois possui uma concentração entre 3% e 5% de ácido acético. Reduções de vinagre balsâmico são ainda mais concentradas.
Pode atendê -lo: dimetilamina ((CH3) 2NH): estrutura, propriedades, usos, riscosO mesmo sangue de nossas veias, depois de suar muito.
Ao se exercitar e suar, o corpo elimina água e sais, mas elimina mais água do que os sais (o suor é hipotônico) para que o sangue se concentre e se torne hipertônico.
Água do mar
A água do mar contém muitos sais dissolvidos, com uma concentração total de cerca de 3,5%, o que o torna hipertônico. É por isso que a água do mar enruga nossos dedos.
Bebidas açucaradas
Bebidas de cola e outras bebidas açucaradas podem conter até 10% de açúcar, além de sais e outros solutos com concentrações maiores que o sangue.
Solução de dextrose a 5% e cloreto de sódio a 0,45% (d5 ½ ns)
Este é um exemplo de uma solução hipertônica que é usada para alimentar pessoas que normalmente não podem comer pela boca.
25% de manitol
Esta é uma solução frequentemente usada para tratar choques na cabeça. É quatro vezes mais concentrado que o sangue.
7,5% de solução salina
É uma solução salgada bastante concentrada que também é injetada com alguns pacientes com certas doenças nas veias.
Sucos comerciais
Todos os sucos que são comprados no supermercado e que não são naturais, têm concentrações muito altas de açúcar que os tornam hipertônicos.
Referências
- Sweeney J. Gerenciando hipernatremia. Enfermagem. Setembro de 2010; 40 (9): 63.
- Salmoura. Wikipedia. 2021. Tirado de.Wikipedia.org/wiki/salmoura.
- Água do mar. Wikipedia. 2021. Tirado de.Wikipedia.Org/wiki/água do mar.
- Chavaltamrong B, Pidatcha P, Thavisri U. Eletrólitos, açúcar, calorias, osmolaridade e pH de bebidas e água de coco. Sudeste Asiático J Trop Med Saúde Pública. Setembro de 1982; 13 (3): 427-431.
- 5% dextrose e 0.Injeção de cloreto de sódio a 45%, USP. FDA. 2006. Retirado de AccessData.FDA.Gov/DrugSatfda_docs/Label/2006/017607S123LBL.Pdf.
- Llorente G, Niño MC. Manitol versus solução salina hipertônica na neuroanestesia. Revista de anestesiologia colombiana. Janeiro a março de 2015; 43 (1): 29-39.
- Santos mm, e. Tratamento da acidose láctica de rúmen aguda com soluções intravenosas de cloreto de sódio ou bicarbonato fodidas por água intrauminal. Pesquisa em ciências veterinárias. Fevereiro de 2020; 128: 24-34.
- Dini-G. E, Abreu-C. JD, López-M. E. Osmolalidade de bebidas frequentes de consumo. Pesquisa Clinica. Dezembro de 2004; 45 (4).

