Características do samario, estrutura, obtenção, usa

- 4702
- 750
- Ernesto Bruen
Ele samário É um elemento químico pertencente às terras raras, especificamente aos lantanídeos, e cujo símbolo é SM. Seu nome vem do mineral samarskita, em homenagem ao coronel Vassili Samarsky, que era um oficial de mineração russo, e que doou amostras deste mineral para seu estudo. O químico francês, Paul Émile Lecoq, obteve seu óxido e alguns de seus sais do Samarskita em 1879, enquanto trabalhava em Paris.
Lecoq de Boisbaudran geralmente recebe mérito para a descoberta do samário, embora houvesse outros produtos químicos e mineralógicos que anteriormente desenhassem o caminho para encontrá -lo. Não foi até 1901 que o químico francês Eugène Anatole conseguiu produzir a primeira amostra pura de samário.
 Samario Samario armazenou firmemente dentro de uma bolha. Fonte: imagens de alta resolução de elementos químicos/cc por (https: // criativecommons.Org/licenças/por/3.0)
Samario Samario armazenou firmemente dentro de uma bolha. Fonte: imagens de alta resolução de elementos químicos/cc por (https: // criativecommons.Org/licenças/por/3.0) A razão para esse atraso em seu isolamento se deveu ao fato de o samario ser um metal relativamente reativo, por isso não é de natureza pura, mas de fazer parte de muitas massas minerais. Da mesma forma, mantém uma estreita relação geológica com outros elementos de terras raras, como o europium e o neodímio, por isso é difícil separá -lo de tais poluentes.
Samario é um metal com aplicações muito diversas, sendo usadas para câncer, namoro, reatores nucleares, ímãs orgânicos e catálise.
[TOC]
Características do Samario
Físico
O samario tem um brilho branco prateado, mas isso rapidamente se torna ouro2QUALQUER3, que é chamado samaria. É um dos metais lantanídeos mais difíceis e voláteis, com fusão de 1072 e 1900 ºC e de ebulição, respectivamente.
Ele oxida com relativa lentidão quando exposto ao ar ou submerso em óleo mineral. É por isso que deve ser armazenado em bolhas, ou dentro de recipientes selados com argônio ou qualquer outro gás inerte. Quando aquecido a 150 ºC, ele oxida vigorosamente, dizendo faíscas queimadas se ele estiver com força.
Pode atendê -lo: Luteco: estrutura, propriedades, usos, obtençãoProdutos químicos
O samario, como os outros lantanídeos, exibe um estado de oxidação de +3 em quase todos os seus compostos; isto é, é encontrado como um cátion3+. No entanto, também é capaz de adotar o status de oxidação de +2, SM2+, Estar em compostos como SMO (monóxido de samarium), SMS (samarium monossulfida) e SMI2 (Samario diyoduro).
Dissolve -se em água quente e especialmente em ácidos diluídos, como HCl, h2SW4 e cap3COOH; Com exceção do HF, porque forma uma camada de proteção SMF3 desacelerando sua dissolução. Seu óxido, SM2QUALQUER3, É moderadamente básico; portanto, ao se dissolver na água, ele liberará quantidades notáveis de íons OH- Por ação do hidróxido SM (OH)3.
A maioria dos compostos samarium +3 é caracterizada por cores amarelas-verdes, e alguns até se destacam por serem luminescentes.
Estrutura química
À temperatura ambiente, o samário adota uma estrutura cristalina romboédica, que corresponde à fase polimorfa ou α. Quando é aquecido a 731 ºC, ocorre uma transição de fase, densificando seus cristais a uma estrutura hexagonal compacta (HCP), chamada de fase β β β.
Continuando o aquecimento a uma temperatura de 922 ºC, o Samario sofre outra transição para uma estrutura cúbica centrada no corpo (BCC), chamada fase γ.
Os cristais de Samario também podem sofrer outras transições quando são comprimidos sob altas pressões, na ordem de milhares de kilobares, sendo o tetragonal e o duplo compacto hexagonal (DHCP) algumas das estruturas obtidas nesses estudos.
Configuração eletronica
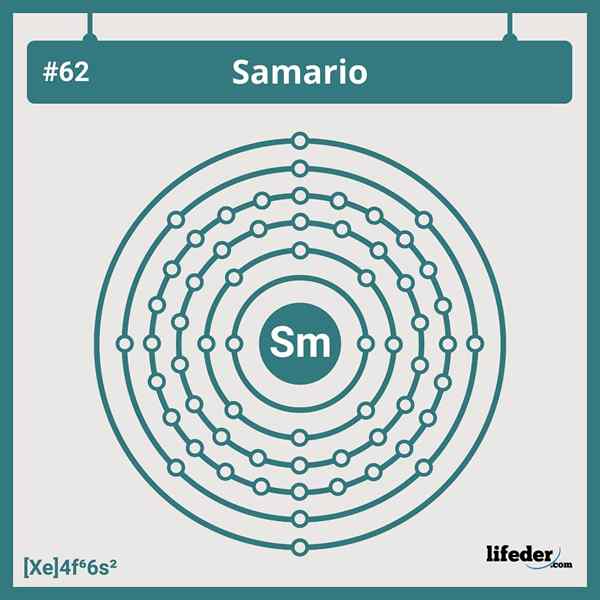 Configuração eletrônica de Samario
Configuração eletrônica de Samario A configuração eletrônica abreviada do samario é:
Pode atendê -lo: fosfato de di -hidroxiacetona (DHAP): características e aplicações[Xe] 6s24f6
Possui seis elétrons em seus orbitais 4F, que concordam com sua posição no sexto grupo de Lanthanides. Portanto, sua configuração eletrônica não é sobre nenhum dos muitos desvios que vemos na tabela periódica.
Obtenção
 Areia mineral monazita, matéria -prima principal para obter o samário. Fonte: d. Kemp, a. C. Cilliersssssllyly modificado por Gretarson (barra vermelha substituída e mal visível por um branco)/CC BY-SA (https: // CreativeCommonsns.Org/licenças/BY-SA/4.0)
Areia mineral monazita, matéria -prima principal para obter o samário. Fonte: d. Kemp, a. C. Cilliersssssllyly modificado por Gretarson (barra vermelha substituída e mal visível por um branco)/CC BY-SA (https: // CreativeCommonsns.Org/licenças/BY-SA/4.0) Apesar de fazer parte das terras raras, a abundância do samario é superior à de Tin e outros metais. Está associado à ferrugem de metais de terras raras, compondo esses minerais como Cerita, La Gadolinita, La Monazita e La Bastnasita, sendo o monazita uma de suas principais fontes mineralógicas, pois contém cerca de 2.8% de samário.
Existem vários métodos para obtê -lo. Um deles consiste em processar as areias monazitas e separar os íons SM3+, por soluções e extrações subsequentes de solventes ou usando cromatografia de troca iônica.
Os íons de Samario são obtidos como SMCL3, Eles são submetidos a eletrólise com uma mistura derretida de NaCl ou CACL2. Por outro lado, se esses íons forem obtidos como SM2QUALQUER3, Então o óxido é reduzido em um derretimento do tântalo usando Lantano, onde os vapores do samarium são destilados devido ao seu ponto de ebulição inferior. A equação para esta redução é a seguinte:
VÓS2QUALQUER3 + 2la → 2sm + o2QUALQUER3
A redução é realizada quente (perto de 1400 ° C) e dentro de um forno de indução de vácuo, o que acelera ainda mais a destilação dos vapores resultantes do samário.
Usos/aplicações do samario
Ímãs
 Ímãs SMCO são usados como parte dos componentes funcionais dos relógios de quartzo. Fonte: © 2010 por Tomasz Sienicki [Usuário: TSCA, Mail: Tomasz.Sienicki no Gmail.com]/cc por (https: // criativeCommons.Org/licenças/por/3.0)
Ímãs SMCO são usados como parte dos componentes funcionais dos relógios de quartzo. Fonte: © 2010 por Tomasz Sienicki [Usuário: TSCA, Mail: Tomasz.Sienicki no Gmail.com]/cc por (https: // criativeCommons.Org/licenças/por/3.0) O samario é ligado ao cobalto para dar origem às ligas SMCO, cuja magnetização é permanente e cerca de 10000 vezes maior que a de ferro.
Pode atendê -lo: operações da unidadeEsses ímãs samario-cololto são usados principalmente nas persianas das câmeras, fones de ouvido, motores, pílulas de guitarra elétrica, bem como em aplicações militares, onde apóiam temperaturas maiores que 400 ° C.
Medicamento
 Estrutura molecular Quadramet, 153SM-EDTMP.
Estrutura molecular Quadramet, 153SM-EDTMP. O próprio samario é relativamente tóxico. No entanto, um de seus isótopos radioativos, o 153SM, reclamado por uma molécula EDTMP (etilendiaminotetrametileno -fosfonato, imagem acima), serve para combater a dor no tratamento de cânceres de próstata, pulmão e seios. Este medicamento é chamado Samario (153SM) Lexidronam, conhecido comercialmente como Quadramet.
Reatores nucleares
O isótopo 149SM é um excelente absorvente de nêutrons, por isso é usado em reatores nucleares para controlar as reações e evitar uma explosão.
eletrônicos
O SMS faz a diferença de temperatura na eletricidade, por isso é usada como termoelétrica em diferentes equipamentos. Ele também tem a peculiaridade de se tornar metálico sob pressões relativamente baixas.
Namorando
A decaimento alfa do isótopo 147VÓS (t1/2= 1.06 × 10onze) para o isótopo 143ND, é usado para namorar amostras de rochas ou meteoritos dentro ou fora da terra. Tem a vantagem de que os átomos 147Sm e 143ND compartilham as mesmas características geológicas, ou seja, elas não sofrem grandes separações durante os processos metamórficos.
Catálise
O samario é usado na síntese orgânica como o SMI2, agindo como um agente redutor em numerosas síntese de versões sintéticas de produtos naturais. Por outro lado, o SM2QUALQUER3 É um catalisador para a desidratação e desidrogenação do etanol.
Referências
- Shiver & Atkins. (2008). Química Inorgânica. (quarta edição). Mc Graw Hill.
- Wikipedia. (2020). Samário. Recuperado de: em.Wikipedia.org
- Oleg d. Neikov e Stanislav S. (2019). Manual de pós de metal não ferrosos: tecnologias e aplicações. (Segunda edição). Cientedirect.
- Os editores da Enyclopaedia Britannica. (2020). Samário. Recuperado de: Britannica.com
- Centro Nacional de Informações sobre Biotecnologia. (2020). Samário. Elemento PubChem. Recuperado de: pubchem.NCBI.Nlm.NIH.Gov
- Dr. Doug Stewart. (2020). Fatos do elemento samarium. Recuperado de: Chemicool.com
- Strekopytov, s. (2016). Saudação ao samário. Nature Chem 8, 816. doi.org/10.1038/NHEM.2565

