Sais de diazônio

- 903
- 155
- Gilbert Franecki
Explicamos o que são sais de diazônio, como suas propriedades e aplicações são formados
O que são sais de diazônio?
As Sais de diazônio São compostos orgânicos nos quais existem interações iônicas entre o grupo azo (-n2+) E um ânion x- (Cl-, F-, CH3COO-, etc.). Sua fórmula química geral é RN2+X-, e nisso a cadeia lateral R pode ser bem um grupo alifático ou um grupo aril; isto é, um anel aromático.
Na imagem inferior, a estrutura do íon arenodiazonium é representada. As esferas azuis correspondem ao grupo azo, enquanto preto e branco compõem o anel aromático do grupo fenil. O az+≡N).

No entanto, existem estruturas de ressonância que delocalizam essa carga positiva, por exemplo, no átomo do nitrogênio vizinho: -n = n+. Isso se origina quando alguns elétrons formando o link são direcionados para o átomo de nitrogênio à esquerda.
Da mesma forma, essa carga positiva é capaz de democar através do sistema Pi do anel aromático. Como conseqüência, os sais de diazônio aromático são mais estáveis que os alifáticos, uma vez que a carga positiva não pode democar ao longo de uma cadeia de carbono (CH3, CH2CH3, etc.).
Treinamento
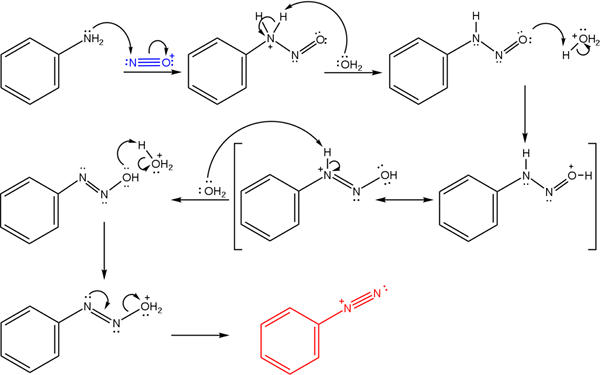
Esses sais derivam da reação de uma amina primária com uma mistura ácida de nitrito de sódio (nano2).
Aminas secundárias (r2NH) e terciário (R3N) Outros produtos de nitrogênio, como N-nitrosoamina (que são óleos amarelados), sais de amina (r3Hn+X-) e compostos n-nitrosonium.
A imagem superior ilustra o mecanismo pelo qual a formação de sais de diazônio, ou também conhecida como reação de diazotização é governada.
Pode atendê -lo: Chrome (CR)A reação começa com a fenilamina (AR-NH2), que realiza um ataque nucleofílico ao átomo de cátion de nitrosonium (não+). Este cátion é produzido pela mistura de nano2/Hx, onde x geralmente é Cl; isto é, hcl.
A formação do cátion de nitrosonium libera água no meio, que arrebata um próton de nitrogênio carregado positivamente.
Então, essa mesma molécula de água (ou outras espécies ácidas diferentes de H3QUALQUER+) produzir um próton ao oxigênio, democrando a carga positiva no átomo de nitrogênio menos eletronegativo).
Agora, a água novamente desprotegida para o nitrogênio e, em seguida, produzindo a molécula de diazo -hidróxido (o antepenúltimo da sequência).
Como o meio é ácido, o diazo -hidróxido sofre desidratação do grupo OH; Para combater a vaga eletrônica, o torque livre do link triplo do grupo azo.
Dessa forma, no final do mecanismo, o cloreto de bencenodiazonium permanece em solução (c6H5N2+Cl-).
Propriedades
Em geral, os sais de diazônio são incolores e cristalinos, solúveis e estáveis a baixas temperaturas (menos de 5 ° C).
Alguns desses sais são tão sensíveis ao impacto mecânico, que qualquer manipulação física pode detoná -los. Finalmente, eles reagem com água para formar fenóis.
Reações de deslocamento
Os sais de diazônio são potenciais nitrogênio molecular, cuja formação é o denominador comum das reações de deslocamento. NESTES, uma espécie X desloca o grupo azo instável, escapando como n2(g).
Reação de Sandmeyer
RNA2+ + CUCL => ARCL + N2 + Cu+
RNA2+ + CUCN => arcn + n2 + Cu+
Reação de Gatterman
RNA2+ + Cux => arx + n2 + Cu+
Ao contrário da reação de Sandmeyer, a reação de Gatterman tem cobre de metal em vez de seu falido; isto é, o cux é gerado No local.
Reação de Schiemann
[RNA2+] BF4- => ARF + BF3 + N2
Pode atendê -lo: cetonas: tipos, propriedades, nomenclatura, usos, exemplosA reação de Schiemann é caracterizada pela decomposição térmica do fluoroborador de benzezônio.
Reação de Gomberg Bachmann
[RNA2+] Cl- + C6H6 => AR - C6H5 + N2 + Hcl
Outros deslocamentos
RNA2+ + Ki => ari + k+ + N2
[RNA2+] Cl- + H3Po2 + H2O => C6H6 + N2 + H3Po3 + Hcl
RNA2+ + H2O => aroh + n2 + H+
RNA2+ + Carimbo2 => Arno2 + N2 + Cu+
Reações redox
Os sais de diazônio podem ser reduzidos a arilidrazinas, usando uma mistura de CNCL2/Hcl:
RNA2+ => Arnhnh2
Eles também podem ser reduzidos a arilaminas em reduções mais fortes com Zn/HCl:
RNA2+ => Rnah2 + NH4Cl
Decomposição fotoquímica
[RNA2+] X- => Arx + n2
Os sais de diazônio são sensíveis à decomposição pela incidência de radiação ultravioleta ou em comprimentos de onda muito próximos.
Reações de acoplamento azo
RNA2+ + Ar'h → rna2Ar ' + h+
Essas reações são talvez as mais úteis e versáteis dos sais de diazônio. Esses sais são eletrofilos fracos (o anel realoca a carga positiva do grupo azo). Para reagir com compostos aromáticos, eles precisam ser carregados negativamente, causando assim compostos azos.
A reação passa com desempenho eficiente entre um pH de 5 e 7. No ácido pH, o acoplamento é menor porque os prótons do grupo azo, tornando impossível o ataque do anel negativo.
Além disso, no pH básico (maior que 10), o sal de diazônio reage com oh- Produzir diazo -hidróxido, que é relativamente inerte.
Estruturas desse tipo de compostos orgânicos têm um sistema PI conjugado muito estável, cujos elétrons absorvem e emitem radiação no espectro visível.
Consequentemente, os compostos azo são caracterizados por serem coloridos. Devido a esta propriedade, eles também foram chamados de cores azóicas.
Pode atendê -lo: molaridade: concentração, unidades, cálculo, exercícios
A imagem superior ilustra o conceito de acoplamento com a laranja de metila como exemplo. No meio de sua estrutura, o grupo azo pode ser observado servindo como o conector dos dois anéis aromáticos.
Qual dos dois anéis foi a eletrofia no início do acoplamento? O da direita, porque o grupo sulfonato (-so3) Remova a densidade eletrônica do anel, tornando -o ainda mais eletrofilo.
Formulários

Uma de suas aplicações mais comerciais é a produção de corantes e pigmentos, cobrindo também a indústria têxtil em delas de tecido. Esses compostos azóicos estão ancorados em locais moleculares específicos do polímero, morrendo de cores.
Devido à sua decomposição fotolítica, é (menos do que antes) usado na reprodução de documentos. Como? As áreas de papel cobertas por um plástico especial são removidas e, em seguida, uma solução básica de fenol é aplicada, colorindo as letras ou design azul.
Na síntese orgânica, eles são usados como pontos de partida para muitos derivados aromáticos.
Finalmente, eles estão tendo aplicações no campo de materiais inteligentes. Nestes, uma superfície (ouro, por exemplo) está ligada, permitindo que ela dê uma resposta química a estímulos físicos externos.

