Características de Takera, Estrutura, Funções
- 1352
- 391
- Conrad Schmidt
O Sakera, Também conhecido como complexo de Tabera-isomaltase, é um complexo enzimático membranal com atividade de α-glicosilase pertencente ao grupo de hidrolases abrangentes (consistindo em glicosidases e peptidases).
Está presente nos microvings intestinais de muitos animais terrestres, como mamíferos, pássaros e répteis. De acordo com diferentes fontes bibliográficas, outros nomes aceitos dessa enzima são oligo-1,6-glucosidase, α-metillucosidase, isomaltase e oligossacarídeo α-1,6-glucosidase.
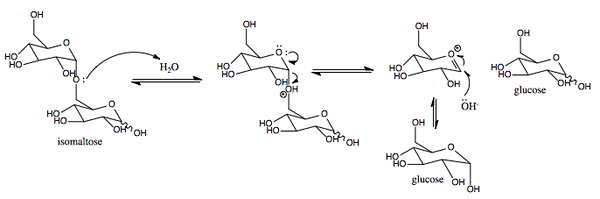
 Representação gráfica do mecanismo de ação das sacas.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)] via Wikimedia Commons)
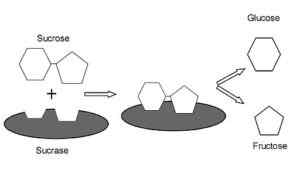
Representação gráfica do mecanismo de ação das sacas.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)] via Wikimedia Commons) É uma enzima com atividade semelhante ao invertido foi encontrado em plantas e microorganismos. Sua função principal é hidrolisar a ligação glucosídica entre monossacarídeos (glicose e frutose) que compõem a sacarose ingerida com comida.
Possui funções digestivas muito importantes, uma vez que a sacarose não pode ser transportada como um dissacarídeo para células intestinais e, portanto, sua hidrólise permite a absorção intestinal de seus monossacarídeos constituintes.
A síntese e a atividade da suger-isomaltase nas células intestinais dos animais são reguladas em muitos níveis: durante a transcrição e a tradução, durante a glicosilação e também durante seu processamento pós-tradução.
Quando qualquer um desses eventos falha ou algum tipo de mutação ocorre no gene que o codifica, em humanos há uma condição patológica conhecida como síndrome da deficiência de sacarose, que está relacionada à impossibilidade de metabolizar os dissacarídeos.
[TOC]
Caracteristicas
Os dissacarídeos que servem como substrato para mamíferos em mamíferos geralmente são o produto da atividade hidrolítica de enzimas α-amilases salivares e pancreáticas. Isso se deve ao fato de que Sacas não apenas hidrolisa as ligações glucosídicas da sacarose, mas também as ligações α-1,4 da maltose e da maltotriiosa e outros oligossacarídeos.
A meia -vida da mesma varia entre 4 e 16 horas, então as células intestinais investem muito.
Pode atendê -lo: qual é a crenação? (Biologia)Síntese
Como as enzimas mais abrangentes da hidrolase, os saco de saco (suitor-isomaltase ou sim) é uma glicoproteína sintetizada em células de borda de escova, como um precursor de polipeptídeo denotado pro-if.
Esta molécula precursora é transportada para a superfície apical das células e é processada enzimaticamente por proteases pancreáticas que a dividem em duas subunidades diferentes: a subunidade isomaltase e a subunidad subunidad.
A subunidade isomaltase corresponde à extremidade do amino terminal do pró-Si e possui um segmento hidrofóbico (âncora hidrofóbica) em sua extremidade N-terminal. Isso permite que você se associe à membrana plasmática das células intestinais com borda da escova.
O gene que codifica esse complexo em humanos está localizado no longo braço do cromossomo 3 e, dada a grande homologia de sequência entre as duas subunidades (mais de 40%), foi sugerido que essa enzima surgiu através de um evento de duplicação genética.
Está provado que ambas as subunidades, isomaltase e sacas, são capazes de hidrolyz.
Estrutura
A forma inicial da enzima sacas, o polipeptídeo pró-Si, possui aproximadamente 260 kDa e 1827 aminoácidos. No entanto, a atividade proteolítica das proteases pancreáticas produz duas subunidades de 140 kDa e 120 kDa, que representam a isomaltase e as sacaras, respectivamente.
Esta enzima é uma glicoproteína com porções sacaridadas N- e QUALQUER-As glicosiladas e os estudos de sua sequência revelam a presença de mais de 19 sites de glicosilação. As porções de carboidratos representam mais de 15% do peso da proteína e são essencialmente compostas de ácido sinalico, galactosamina, mão e n-acetilglucosamina.
Pode atendê -lo: Leucina: características, estrutura, funções, biossínteseComo as duas subunidades do complexo sacrase-isomaltase não são exatamente as mesmas, muitos autores consideram que essa enzima é, na realidade, um heterodímero em que cada subunidade consiste em uma cadeia de polipeptídeos lineares glicosilados e que está associada através de links não covalentes.
A subunidade isomaltase possui um segmento hidrofóbico de 20 resíduos de aminoácidos envolvidos em sua associação com a membrana dos enterócitos (células intestinais) e que representam uma âncora permanente e um sinal peptídico para ir ao retículo endoplasmático.
O local ativo de ambas as subunidades, sacas e isomaltase, é encontrado na membrana plasmática dos enterócitos, saindo para o lúmen intestinal intestinal.
Funções
As principais funções metabólicas de enzimas como a suitor-isomaltase estão relacionadas à produção de glicose e frutose a partir de sacarose. Monossacarídeos que são transportados para células intestinais e incorporadas em diferentes rotas metabólicas com diferentes fins.
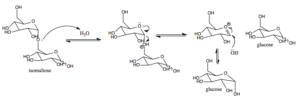 Mecanismo de ação da açúcar-isomaltase em mamíferos (fonte: Areid3 [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)] via Wikimedia Commons)
Mecanismo de ação da açúcar-isomaltase em mamíferos (fonte: Areid3 [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)] via Wikimedia Commons) A glicose, para a qual existem transportadores específicos, pode ser direcionada intracelularmente à glicólise, por exemplo, onde sua oxidação leva à produção de energia na forma de ATP e redução do poder na forma de NADH.
A frutose, por outro lado, também pode ser metabolizada por uma série de reações que começam com sua fosforilação para frutose 1-fosfato e catalisadas por uma frutocinase hepática. Isso começa a inclusão desse substrato a outras rotas de produção de energia.
Além disso, como na enzima invertida em plantas, a atividade do açúcar-isomaltase tem implicações importantes em aspectos celulares, como pressão osmótica, que geralmente condicionam eventos fisiológicos, como crescimento, desenvolvimento, transporte de moléculas e outros.
Doenças relacionadas a humanos
Existe uma doença autossômica congênita em humanos conhecidos como deficiência de suitor-isomaltasa ou csid (inglês Deficiência congênita de Lindy-Isomaltase), que está relacionado a defeitos nos dissacarídeos oligo e osmoticamente ativos.
Pode atendê -lo: efeito de fundaçãoEsta doença tem a ver com vários fatores simultâneos, entre os quais a acusação incorreta da forma precursora pró-IF da enzima, mutações genéticas, erros durante o transporte etc.
Essa condição é difícil de diagnosticar, sendo frequentemente confundida com uma intolerância à lactose. Portanto, também é conhecido como "intolerância à sacarose".
É caracterizada pelo desenvolvimento de cólicas abdominais, diarréia, vômito, jaquecas acompanhadas de hipoglicemia, falta de crescimento e ganho de peso, ansiedade e produção excessiva de gases.
Referências
- Brunner, J., Hauser, h., Braun, h., Wilson, k., Wecker, w., O'Neill, b., & Semenza, G. (1979). O modo de associação do complexo enzimático lygase-isomaltase com a membrana da borda da escova intestinal. O Journal of Biological Chemistry, 254(6), 1821-1828.
- Cowell, g., Tranum-Jensen, J., Sjöström, h., & Norén, ou. (1986). Topologia e estrutura quaternária de pró-sucrase / isomaltase e formato final SimIed / isomaltase. Jornal Bioquímico, 237, 455-461.
- Hauser, h., & Semenza, G. (1983). Limade-isomaltase: uma proteína intrínseca perseguida da membrana da borda da escova. Críticas críticas em bioch, 14(4), 319-345.
- Hunziker, w., Spiesss, m., Semenza, g., & LODISH, H. F. (1986). O complexo Limade-lsomaltase: estrutura primária, orientação da membrana e evolução de uma proteína de borda de escova intrínseca e perseguida. Célula, 46, 227-234.
- Naim, h. E., Roth, J., Sterchi, e. E., Lentze, m., Mile, p., Schmitz, J., & Hauril, H. (1988). Deficiência de Lind-Isomaltase em humanos. J. Clin. Investir., 82, 667-679.
- Rodriguez, i. R., Taravel, f. R., & Whelan, w. J. (1984). Caracterização e função da linde-isomaltase intestinal de porco e suas subunidades separadas. EUR. J. Biochem., 143, 575-582.
- Schiweck, h., Clarke, m., & Pollach, G. (2012). Açúcar. Em Enciclopédia de química industrial de Ullmann (Vol. 34, p. 72). Wiley-VCH Verlag GmbH & Co. KGAA.
- Treem, w. (novecentos e noventa e cinco). Deficiência congênita de Lindy-Isomaltase. Jornal de Gastroenterologia e Nutrição Pediátrica, vinte e um, 1-14.
- « Características da gastrina, estrutura, produção, funções
- Os 11 principais tipos de engenharia e suas características »

