Regra de afundar ou multiplicidade máxima

- 4078
- 294
- Alfred Kub
Explicamos qual é a regra ou princípio da máxima multiplicidade de hund, etapas para aplicá -la e dar vários exemplos
 Fonte: Gabriel Bolívar
Fonte: Gabriel Bolívar Qual é a regra da pia?
O Regra da pia, Também chamado de princípio de multiplicidade máxima de spin, é uma regra empírica usada para escrever a configuração eletrônica absoluta dos elementos químicos quando eles estão em seu estado fundamental. Ou seja, é uma regra que ajuda a prever como os elétrons são distribuídos nos orbitais atômicos de um átomo que é relaxado ou em seu menor nível de energia.
A regra da pia diz:
"... Em um átomo que está em seu estado fundamental, os elétrons do mesmo nível de energia serão distribuídos de tal maneira que existe o máximo possível de espinhos paralelos".
Esta regra corresponde a um dos princípios fundamentais da mecânica quântica e da teoria atômica atual. É muito útil entender algumas propriedades dos diferentes elementos, especialmente suas propriedades magnéticas. Isso ocorre porque os átomos são atraídos ou repelidos por ímãs, pois desapareceram elétrons em sua estrutura.
De onde vem a regra de pia ou multiplicidade máxima?
Espectros atômicos
Este princípio primeiro enunciou o físico alemão Friedrich Hund em 1927. Sink estudou espectros de absorção atômica, que permitem medir experimentalmente a energia que os elétrons absorvem quando expostos à radiação eletromagnética do comprimento de onda adequado. Observações experimentais só poderiam ser explicadas se o átomo possuísse o máximo de elétrons possível com o mesmo giro.
Elétrons ausentes
Além dos espectros atômicos, existem outras observações experimentais que confirmam as configurações eletrônicas que são previstas pela aplicação da regra de hund. O mais importante consiste nas medidas experimentais das propriedades magnéticas dos átomos que permitem determinar quantos elétrons ausentes têm um átomo.
Pode atendê -lo: eletrólise de águaOs elétrons ausentes são aqueles que estão sozinhos em um orbital, sem o respectivo casal de spin opostos.
Etapas para aplicar a regra de pia
A regra do coletor se aplica quando escrevemos a configuração eletrônica de um átomo em seu estado fundamental. Isso significa que é uma regra complementar de outras regras, como o princípio da Aufbau ou o princípio da construção (também chamado de regra de chuva) e o princípio de exclusão de Pauli.
Apenas se aplica aos casos em que queremos.
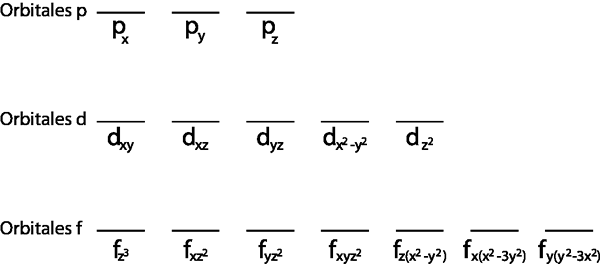
Além disso, faz sentido aplicá -lo à camada de Valência, ou seja, esse nível de energia incompleto (não possui todos os elétrons que se encaixam nele). Caso contrário, todos os elétrons seriam emparelhados para cumprir o princípio de exclusão de Pauli.
A aplicação desta regra consiste nas seguintes etapas:
- Etapa 1: desenhe uma linha horizontal ou um pequeno retângulo para cada orbital do sub -nível.
- Etapa 2: coloque o primeiro elétron no primeiro orbital com o seu giro apontando para cima.
- Etapa 3: coloque o seguinte elétron no próximo orbital, apontando também.
- Etapa 4: continue assim até que os elétrons terminem ou não haja mais orbitais vazios.
- Etapa 5: Se, ao colocar um elétron em cada orbital, ainda existem elétrons a serem distribuídos, repita as etapas 2 a 4, mas colocando os elétrons com o giro apontando para baixo.
Para entender como essas etapas se aplicam, vamos analisar alguns exemplos.
Exemplo 1: Configuração eletrônica de nitrogênio
O nitrogênio é o elemento número 7, por isso possui um total de 7 elétrons girando em torno do núcleo. Esses elétrons são distribuídos da seguinte forma, seguindo a regra de chuva:
Pode atendê -lo: acetanilide (C8H9NO)1s2 2s2 2 p3
Como podemos ver, a camada de valência de nitrogênio corresponde ao nível 2 de energia (chamado camada L), no qual 8 elétrons se encaixam. No entanto, o nitrogênio possui apenas 5 elétrons de valência.
Nos orbitais s Apenas 2 elétrons se encaixam, portanto o orbital 2S está completamente cheio e não faz sentido aplicar a regra do coletor para este orbital.
Por outro lado, o sub -nível 2p, que contém 3 orbitais, não está cheio. Mas como esses 3 elétrons são distribuídos nesses três orbitais? Eles são distribuídos seguindo as etapas da regra da pia, que são apresentadas abaixo:
Etapa 1: desenhe uma linha horizontal ou um pequeno retângulo para cada orbital do sub -nível.
Como é o sub -nível 2P, existem três orbitais que são os 2px, 2 pe e o 2pz. Então, devemos desenhar três listras horizontais ou três caixas ou retângulos:
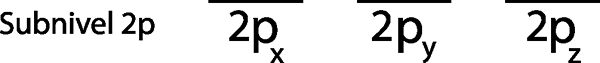
Cada uma dessas faixas ou caixas representa um orbital, como indicado pelo nome que tem cada um deles.
Etapa 2: coloque o primeiro elétron no primeiro orbital com o seu giro apontando para cima.
Colocamos o primeiro elétron no 2P Orbitalx Como este é o primeiro orbital na lista.
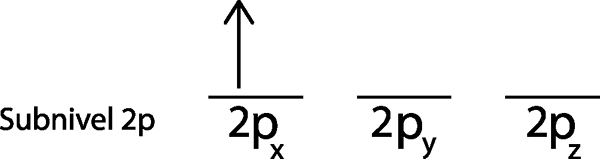
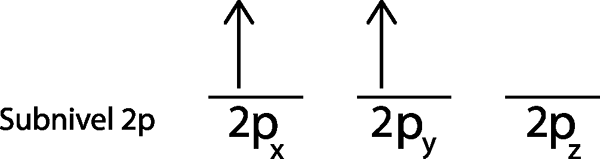
Etapa 3: coloque o seguinte elétron no próximo orbital, apontando também.
O segundo elétron está localizado no 2P Orbitale
Etapa 4: continue assim até que os elétrons terminem ou não haja mais orbitais vazios.
No nosso caso, precisamos apenas distribuir 3 elétrons, então precisamos apenas colocar o último elétron no último orbital e pronto:
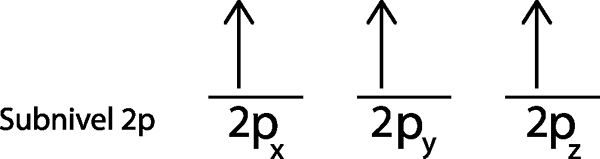
Como pode ser visto, o princípio da máxima multiplicidade ou regra de afundamento prevê que o nitrogênio atômico deve ter 3 elétrons ausentes.
Pode atendê -lo: óxidos de nitrogênio (NOX)Nesse caso, não era necessário aplicar a etapa 5, pois após a etapa 4 ficamos sem elétrons para distribuir.
Exemplo 2: Configuração eletrônica de ferro
O ferro é o elemento 26 e sua configuração eletrônica é:
1s2 2s2 2 p6 3s2 3p6 3d6 4s2
Nesse caso, podemos observar que o orbital com o nível de energia mais alto é 4s, mas por ser um metal de transição, o ferro tem um orbital parcialmente completo D. Este é o orbital cujos elétrons distribuímos seguindo a regra de hund.
Etapa 1: desenhe uma linha horizontal ou um pequeno retângulo para cada orbital do sub -nível.
Vamos preencher o sub -nível 3D que contém 5 orbitais:
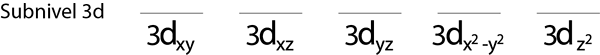
Etapa 2: coloque o primeiro elétron no primeiro orbital com o seu giro apontando para cima.
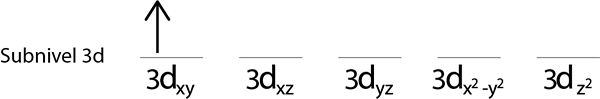
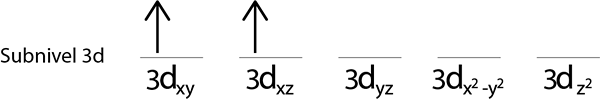
Etapas 3: coloque o seguinte elétron no seguinte orbital, apontando também.
Etapa 4: continue assim até que os elétrons terminem ou não haja mais orbitais vazios.
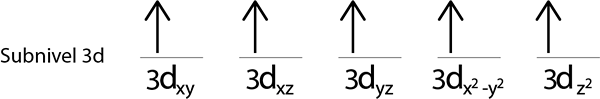
Etapa 5: Se, ao colocar um elétron em cada orbital, ainda existem elétrons a serem distribuídos, repita as etapas 2 a 4, mas colocando os elétrons com o giro apontando para baixo.
Como ainda temos um elétron para distribuir depois de colocar um elétron em cada orbital 3D, o último dos 6 elétrons é colocado com a rotação oposta no primeiro orbital.
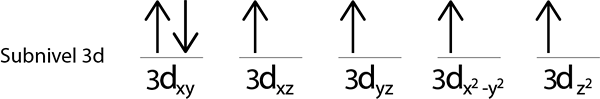
Esta é a configuração absoluta de um átomo de ferro em seu estado fundamental. Na mesma forma, o ferro tem 4 elétrons ausentes com espinhos paralelos.
Referências
- Sem resposta, perguntas sobre a máxima multiplicidade ou regra de afundamento: o que deve ser feito (2020). Retirado do Physis andQuimica.com.
- Pia - Química (2021). Retirado de CostProject.org.
- Multiplicidade máxima de Sind (2020). Retirado de Princiodo.com.
- Regra da pia | The Chemistry Guide (2012). Tirado da química.LaGuia2000.com.

