Características e exemplos reversíveis de reação
- 4582
- 761
- Ernesto Bruen
A Reação reversível É aquele que em algum momento de seu curso atinge um estado de equilíbrio no qual as concentrações dos reagentes e produtos permanecem constantes; isto é, eles não variam, porque a velocidade com que um é consumido é o mesmo com o qual o outro aparece. Dizem também que esse estado corresponde a um equilíbrio dinâmico.
No entanto, o equilíbrio pode ser visto como uma conseqüência da reversibilidade de uma reação química; Como em reações irreversíveis, é impossível estabelecer qualquer equilíbrio. Para que isso aconteça, os produtos devem ser capazes de reagir entre si, sob condições específicas de pressão e temperatura, originárias retornadas aos reagentes.
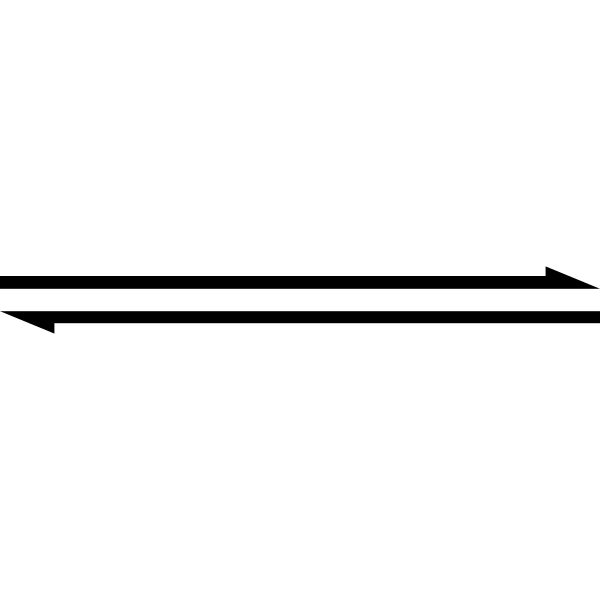
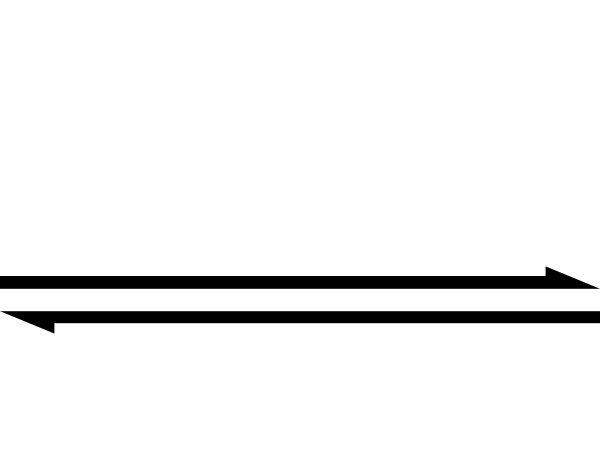 O símbolo de seta dupla indica que uma reação é reversível. Fonte: Esta imagem SVG foi criada pelo Medium69.Cette imagem svg a eté créée par perium69.Por favor, credite isto: William Crochot [Domínio Público]
O símbolo de seta dupla indica que uma reação é reversível. Fonte: Esta imagem SVG foi criada pelo Medium69.Cette imagem svg a eté créée par perium69.Por favor, credite isto: William Crochot [Domínio Público] O acima é simplificado usando o símbolo de seta dupla (com duas pontas antiparalelas). Quando o vemos em uma equação química, significa que a reação prossegue em ambas as direções: da esquerda para a direita (formação do produto) e da direita para a esquerda (reagente ou formação reativa).
A minoria das reações químicas é reversível e são encontradas mais do que todas na síntese orgânica e inorgânica. Nestes, é de grande importância saber quais condições favorece o equilíbrio para estimar as quantidades de produto que podem ser obtidas.
[TOC]
Características de reações reversíveis
Equação e equilíbrio geral
Uma reação reversível tem a seguinte equação geral, considerando que existem apenas dois reagentes, A e B:
A + B ⇌ C + D
A seta dupla indica que A e B reagem para produzir C e D, mas também C e D podem reagir um ao outro para regenerar os reagentes; isto é, a reação na direção oposta, da direita para a esquerda, ocorre.
Pode atendê -lo: o que é o erristenoo?A reação direta origina produtos, enquanto os inversos, reagentes. Se um é exotérmico, o outro pela lógica deve ser endotérmico e ambos ocorrem espontaneamente; Mas não necessariamente na mesma velocidade.
Por exemplo, A e B podem ser menores ou instáveis que C e D; E, portanto, eles consomem mais rápido que C e D podem regenerá -los.
Se os produtos C e D mal reagirem um ao outro, haverá um maior acúmulo de produtos do que os reagentes. Isso significa que, quando o equilíbrio químico for alcançado, teremos maiores concentrações de C e D do que de A ou B, independentemente de suas concentrações não variarem.
Dizem então que o saldo é deslocado para a esquerda, onde haverá mais produtos do que reagentes.
Princípio de Le Châtelier
Uma reação reversível é caracterizada por ocorrer em ambas as direções em uma equação química, atingindo um ponto de equilíbrio e respondendo a mudanças ou influências externas após o princípio de Le Châtelier.
De fato, graças a esse princípio, as observações de Berthollet poderiam ser explicadas em 1803, quando ele reconheceu os cristais de Na2Co3 Em um lago de areia localizado no Egito. A reação de deslocamento duplo seria:
N / D2Co3(AC) + CACL2(AC) ⇌ NaCl (AC) + Caco3(AC)
Para que a reação reversa ocorra, deve haver um excesso de NaCl e, portanto, o equilíbrio se moveria para a direita: em direção à formação de Na2Co3.
Essa característica é de grande importância, porque as pressões ou temperaturas também são manipuladas para favorecer o significado da reação gerada pela espécie de interesse.
Mudanças químicas
As mudanças químicas das reações reversíveis tendem a ser menos evidentes do que as observadas para reações irreversíveis. No entanto, existem reações, especialmente aquelas em que os complexos metálicos participam, nos quais vemos as mudanças de coloração dependentes da temperatura.
Pode servir a você: Modelo Atomico de Perrina: Características, PostulaCompostos químicos
Qualquer tipo de composto pode estar envolvido em uma reação reversível. Observou -se que dois sais são capazes de estabelecer um equilíbrio, na2Co3 e CACL2. O mesmo acontece entre complexos metálicos ou moléculas. De fato, grande parte das reações reversíveis é devido a moléculas com links específicos que quebram e se regeneram repetidamente.
Exemplos de reações reversíveis
Dissolução de cloreto de cobalto
Uma solução de cloreto de cobalto, cocl2, Na água, mancha rosa, devido à formação de uma ACU complexa. Quando esta solução é aquecida, a cor muda de azul, dando a próxima reação reversível:
[CO (H2QUALQUER)6]2+(AC) (rosa) + 4cl-(AC) + Q ⇌ Cocl42-(AC) (azul) + 6h2Ou (l)
Onde está o calor fornecido. Esse calor desidra o complexo, mas à medida que a solução esfria, ou se a água for adicionada, ele retornará à sua cor rosa original.
Iodeto de hidrogênio
A reação reversível a seguir é talvez a mais clássica na introdução do conceito de equilíbrio químico:
H2(g) + eu2(s) ⇌ 2Hi (g)
Observe que a reação consegue estabelecer um equilíbrio, mesmo quando o iodo está em estado sólido. Todas as espécies são moleculares: h-h, i-i e h-i.
Hidrólise
Hidrólise são exemplos muito representativos de reações reversíveis. Entre os mais simples, temos o sofrido por um ácido ou base conjugada. A hidrólise do íon amônio, NH4+, e do íon carbonato, co32-, são as seguintes:
NH4+(AC) + H2Ou (L) ⇌ NH3(g) + oh-
Co32-(AC) + H2Ou (l) ⇌ HCO3-(AC) + OH-
Se adicionarmos uma base que fornece íons oh- No meio, substituiremos os dois saldos para a esquerda.
Pode atendê -lo: gadolinio: estrutura, propriedades, obtenção, usosDissolução de cromato-domato
Muito semelhante ao do primeiro exemplo, uma solução de cromato sofre mudanças de cor, mas devido a variações de temperatura, mas pH. A reação reversível é:
2cro42-(AC) (amarelo) + 2h3QUALQUER+(AC) ⇌ Cr2QUALQUER72-(AC) (laranja) + 3h2Ou (l)
Então, se uma dissolução amarela de CRO42- É acidificado com qualquer ácido, sua cor se tornará imediatamente laranja. E se houver alcalina ou muita água for adicionada, o equilíbrio se moverá para a direita, reaparecendo a cor amarela e consumindo o CR2QUALQUER72-.
Amônia
A síntese de amônia, NH3, Envolve uma reação reversível reversível para que o nitrogênio gasoso, uma espécie muito inerte, reaja:
N2(g) + 3h2(s) ⇌ 2NH3(g)
Esterificação
E finalmente um exemplo de química orgânica é mencionada: esterificação. Isso consiste em obter um éster de um ácido carboxílico e um álcool em meio ácido forte. A reação reversível é:
Rcooh + r'oh ⇌ rcoor ' + h2QUALQUER
Referências
- Whitten, Davis, Peck e Stanley. (2008). Química. (8ª ed.). Cengage Learning.
- Walter J. Moore. (1963). Química Física. Em cinética química. Quarta edição, Longmans.
- Irã. Levine. (2009). Princípios da físico -química. Sexta edição, página 479-540. Mc Graw Hill.
- Wikipedia. (2020). Reação reversível. Recuperado de: em.Wikipedia.org
- Helmestine, Anne Marie, Ph.D. (19 de agosto de 2019). Definição de reação reversível e exames. Recuperado de: pensamento.com
- Binod Shrestha. (5 de junho de 2019). Reações reversíveis e irreversíveis. Química Librettexts. Recuperado de: química.Librettexts.org
- David Wood. (2020). Reações químicas reversíveis: definição e exames. Estudar. Recuperado de: estudo.com
- « Fórmula semi -desenvolvida o que são e exemplos (metano, propano, butano ...)
- Características e exemplos irreversíveis da reação »

