Características e exemplos de reação exterminada

- 4927
- 953
- Dennis Heidenreich
A Reação Exerrogônica É aquele que ocorre espontaneamente e que, em geral, é acompanhado por uma liberação de energia, seja na forma de calor, luz ou som. Quando o calor é liberado, diz -se que estamos enfrentando uma reação exotérmica e extermática.
É por isso que os termos 'exotérmicos' e 'exercitados' são confusos, tornando -se tratados por engano como sinônimos. Isso ocorre porque muitas reações exotérmicas também são exterminadas. Portanto, se um grande desapego de calor e luz for observado, como a origem de um incêndio, pode -se assumir que ele consiste em uma reação exercitada.
 A combustão de madeira é um exemplo de uma reação exotérmica e ao mesmo tempo. Fonte: Pixnio.
A combustão de madeira é um exemplo de uma reação exotérmica e ao mesmo tempo. Fonte: Pixnio. No entanto, a energia liberada pode passar despercebida e não ser tão surpreendente. Por exemplo, um meio líquido pode aquecer um pouco e ainda ser uma conseqüência de uma reação exterminada. Em algumas reações exercitadas que passam muito lentamente, o menor aumento de temperatura nem é observado.
O ponto central e característico desse tipo de reações termodinâmicas é a diminuição da energia livre de Gibbs nos produtos em relação aos reagentes, o que se traduz em espontaneidade.
[TOC]
Características das reações exterminadas
Diagrama geral
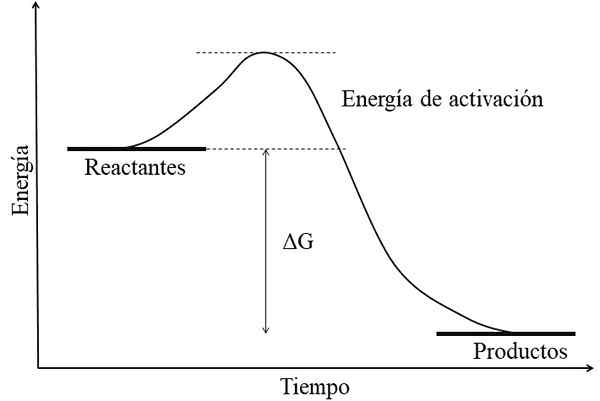 Diagrama de energia para uma reação exercitada. Fonte: Gabriel Bolívar.
Diagrama de energia para uma reação exercitada. Fonte: Gabriel Bolívar. A principal característica de uma reação exercitada é que os produtos têm energias livres de gibss inferiores que as dos reagentes ou reagentes (imagem superior). Esse fato geralmente está associado aos produtos é quimicamente mais estável, com links mais fortes, estruturas mais dinâmicas ou mais condições "confortáveis".
Portanto, essa diferença de energia, ΔG, é negativa (ΔG < 0). Al ser negativa, la reacción en teoría debe ser espontánea. Sin embargo, otros factores también definen dicha espontaneidad, como lo son la energía de activación (la altura de la colina), la temperatura, y los cambios de entalpía y entropía.
Pode atendê -lo: sistema homogêneoTodas essas variáveis que respondem à natureza do fenômeno ou à reação química considerada, permitem determinar se uma reação será ou não exercitada. E também se vê que não precisa necessariamente ser uma reação exotérmica.
Quando a energia de ativação é muito alta, os reagentes exigem a ajuda de um catalisador para reduzir a referida barreira de energia. É por isso que existem reações exercitadas que são dadas em velocidades muito baixas, ou que não ocorrem em primeiro lugar.
Diminuição de energia livre no sistema
A expressão matemática a seguir abrange o que é comentado acima:
ΔG = ΔH - TΔS
O termo ΔH é positivo se for uma reação endotérmica e negativa se for exotérmica. Se queremos que ΔG seja negativo, o termo TΔS deve ser muito grande e positivo, de modo que, ao subtrair a ΔH, o resultado da operação também é negativo.
Portanto, e essa é outra característica especial das reações exterminadas: elas implicam uma grande mudança na entropia do sistema.
Assim, levando em consideração todos os termos, podemos estar presentes antes de uma reação exercitada, mas ao mesmo tempo endotérmica; isto é, com ΔH positivo, uma temperatura muito alta ou uma mudança de grande entropia.
A maioria das reações exercitadas também é exotérmica, porque se ΔH for negativo e, subtraindo outro termo ainda mais negativo, teremos consequentemente um ΔG com valor negativo; A menos que os Tδs sejam negativos (a entropia descendo) e, portanto, a reação exotérmica se tornaria endogônica (não espontânea).
É importante destacar que a espontaneidade de uma reação (exergônica ou não), depende muito das condições termodinâmicas; Enquanto a velocidade com que passa é devido a fatores cinéticos.
Pode servir a você: Matéria Viva: Conceito, Características e ExemplosEspontaneidade de uma reação exercitada
O que foi dito é conhecido, já que uma reação exercitada é espontânea, seja exotérmica. Por exemplo, um composto pode se dissolver em água resfriado junto com seu recipiente. Este processo de dissolução é endotérmico, mas quando acontece espontaneamente, diz -se que é extermurado.
Reação exotérmica
Existem reações "mais exercitadas" do que outras. Para descobrir, a seguinte expressão deve estar à mão:
ΔG = ΔH - TΔS
As reações mais exercitadas são aquelas que são dadas espontaneamente a todas as temperaturas. Ou seja, independentemente do valor de t na expressão anterior, ΔH é negativo e ΔS positivo (ΔH 0). Eles são, portanto, reações muito exotérmicas, o que não contradiz a ideia inicial.
Também pode haver reações exotérmicas em que a entropia do sistema diminui (ΔS < 0); tal como sucede en la síntesis de macromoléculas o polímeros. En este caso, son reacciones exergónicas solamente a bajas temperaturas, ya que de lo contrario el término TΔS sería muy grande y negativo.
Reação endotérmica
Por outro lado, existem reações que são apenas espontâneas em altas temperaturas: quando ΔH é positivo e ΔS positivo (ΔH> 0 e ΔS> 0). Falamos sobre reações endotérmicas. É por isso que as descidas de temperatura podem ocorrer espontaneamente, porque elas carregam um aumento na entropia.
Enquanto isso, existem reações que não são exterminadas: quando Δh e Δs têm valores positivos. Nesse caso, não importa qual a temperatura, a reação nunca ocorrerá espontaneamente. Falamos então, de um fim -reação endarda espalhada.
Pode atendê -lo: fase de dispersãoExemplos de reações exterminadas
A química é geralmente caracterizada por ser explosiva e brilhante, por isso supõe -se que a maioria das reações seja exotérmica e exercitada.
Combustões
As reações exercitadas são as combustões de alcanes, olefinas, hidrocarbonetos aromáticos, açúcares, etc.
Oxidaxes de metal
Da mesma forma, as oxidações dos metais são exterminadas, embora elas passem mais lentamente.
Reações catabólicas do organismo
No entanto, existem outros processos mais sutis, que também são exercitados e muito importantes: as reações catabólicas de nosso metabolismo. Aqui, as macromoléculas se decompõem que atuam como reservatórios de energia, libertando -se de calor e ATP, e graças aos quais o corpo executa muitas de suas funções.
A mais emblemática dessas reações é a respiração celular, oposta à fotossíntese, onde os carboidratos com oxigênio são "queimados" para transformá -los em pequenas moléculas (CO2 e h2O) e energia.
Outros
Entre outras reações exercitadas, temos a decomposição explosiva do nitrogênio triyoduro, ou3; a adição de metais alcalinos aquáticos, seguido de uma explosão; Síntese polimérica de resinas etoxiladas; neutralizações ácidas-base em solução aquosa; e reações de quimioterapia luminescente.
Referências
- Whitten, Davis, Peck e Stanley. (2008). Química. (8ª ed.). Cengage Learning.
- Walter J. Moore. (1963). Química Física. Em cinética química. Quarta edição, Longmans.
- Irã. Levine. (2009). Princípios da físico -química. Sexta edição, página 479-540. Mc Graw Hill.
- Wikipedia. (2020). Reação Exerrogônica. Recuperado de: em.Wikipedia.org
- Helmestine, Anne Marie, Ph.D. (16 de setembro de 2019). Reação e endergônica vs treergônica. Recuperado de: pensamento.com
- Reação Exerrogônica: Definição e Exemplo. (18 de setembro de 2015). Recuperado de: estudo.com
- Academia Khan. (2018). Energia livre. Recuperado de: é.Khanacademy.org
- « Fórmulas de energia mecânica, conceito, tipos, exemplos, exercícios
- Consumo sustentável para o que é uso, importância, ações, exemplos »

