Reação de deslocamento

- 2729
- 821
- Ralph Kohler
Explicamos quais são as reações de deslocamento, os tipos que existem e damos vários exemplos
 A reação entre o cobre metálico e uma solução de nitrato de prata é uma reação de deslocamento que produz nitrato de cobre (II) (que fornece à solução uma coloração azul esverdeada) e prata metálica que cresce na forma de uma cor de cinza prateado de cor do fofo
A reação entre o cobre metálico e uma solução de nitrato de prata é uma reação de deslocamento que produz nitrato de cobre (II) (que fornece à solução uma coloração azul esverdeada) e prata metálica que cresce na forma de uma cor de cinza prateado de cor do fofo O que é uma reação de deslocamento?
O Reação de deslocamento o A reação de reposição é um tipo de reação química na qual um átomo ou um pequeno grupo de átomos em uma molécula é substituído ou deslocado por outro átomo ou grupo de átomos.
As reações de deslocamento podem ser simples ou duplas e são de natureza muito comum. Muitas das reações químicas que vemos diariamente são reações de deslocamento, como a sulfatação de terminais em baterias de carro.
Tipos de reações de deslocamento
Existem dois tipos de reações de deslocamento, simples e duplas, que são descritas abaixo, juntamente com alguns exemplos específicos:
Reação de deslocamento simples
Essas são reações de deslocamento nas quais um elemento substitui outro em um composto químico. Eles são reconhecidos porque, tanto nos reagentes quanto nos produtos, existem apenas duas substâncias envolvidas, e em cada caso um deles é um elemento puro, enquanto o outro é um composto.
Essas reações podem ter uma das seguintes equações gerais:
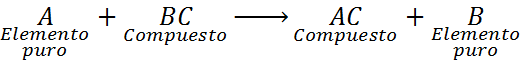
Como pode ser visto, nesta reação, o elemento A reage com o composto BC e desloca ou substitui o elemento B para formar o composto CA.
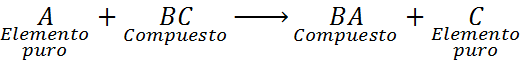
Nesse caso, o elemento A também reage com o composto BC, mas desloca ou substitui o elemento C para formar o composto BA, liberando C na forma de um elemento puro.
Uma das características mais importantes para reconhecer uma reação simples de deslocamento é que o elemento de entrada deve acabar ocupando o mesmo lugar que ocupava o elemento de saída (B ou C, conforme o caso) e isso deve terminar como um elemento puro.
Pode servir a você: Gálio Arseniuro: Estrutura, Propriedades, Usos, RiscoDeve -se notar que, em muitos casos, a parte C da molécula não é necessariamente um elemento individual, mas que pode ser um grupo de átomos como íons nitratos (não3-) ou sulfato (então4-).
Exemplos de reações de deslocamento simples
- Deslocamento de prata por cobre
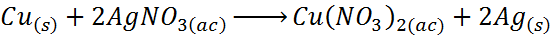
Nesse caso, o cobre (Cu) atua para o elemento A, prata (Ag) corresponde aos íons do elemento B e nitrato (não3-) representar c.
Como você pode ver, nesta reação, o cobre substitui prata em nitrato de prata, liberando a prata de uma maneira elementar.
- Sulfatação de terminais de bateria

Essa reação simples de deslocamento é o que acontece nos terminais ou contatos elétricos de muitos acumuladores de chumbo, ou seja, as baterias presentes na maioria dos carros a gasolina.
A reação é evidenciada pela formação de um sólido branco que cobre os contatos principais dessas baterias. Como pode ser visto na equação, esta é uma reação na qual o chumbo desloca o hidrogênio no ácido sulfúrico.
- Deslocamento de bromo por flúor

Nesse caso, o fluoreto, que é um elemento muito reativo, substitui o bromo em brometo de sódio (NABR) para formar fluoreto de sódio (NAF). Observe que aqui o elemento substituído não é o que aparece primeiro na fórmula composta, mas que é o segundo, como na segunda forma da reação geral mostrada anteriormente.
Pode servir a você: Destilação fracionária: processo, equipamentos, aplicações, exemplosReação de deslocamento duplo
As reações de deslocamento duplo, também chamadas de reações duplas de substituição ou decomposição dupla, podem ser vistas como uma troca de casais. São reações nas quais dois compostos químicos diferentes trocam elementos para formar dois novos compostos diferentes. Essas reações têm a seguinte equação geral:
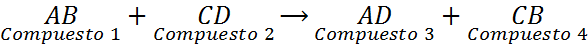
Como pode ser visto nesta reação geral, o elemento A do composto 1 (AB) substitui o elemento do composto 2 (CD) para formar o composto 3 (AD). Ao mesmo tempo, o elemento C do composto 2 (CD) substitui o elemento A do composto 1 (AB) para formar o composto 4 (CB).
Em deslocamentos duplos, é essencial que os elementos que são substituídos entre si ocupem posições equivalentes nos novos compostos. Isso significa que, na reação geral, a, que está à esquerda e, portanto, é provavelmente um cátion, só pode substituir C no composto do CD, mas não pode substituir D.
Isso é semelhante a uma troca de casais de dança. Se todos os casais forem formados por um homem e uma mulher, os novos casais formados após a reação também devem ser formados por um homem e uma mulher.
Exemplos de reações de deslocamento duplo
- Reação entre cloreto de sódio e nitrato de prata

Este é um exemplo claro de uma reação de deslocamento duplo. Aqui, o sódio substitui prata em nitrato de prata para formar nitrato de sódio (nano3), Ao mesmo tempo em que Silver substitui o sódio em cloreto de sódio para formar cloreto de prata (AGCL).
Pode servir você: epid- Reação entre sulfato de cálcio e cloreto de sódio

Nesta reação de deslocamento duplo, o cálcio substitui o sódio no cloreto de sódio para formar cloreto de cálcio, enquanto o sódio substitui o cálcio no sulfato de cálcio para formar sulfato de sódio, assim.
Outra maneira de ver essa reação igualmente válida é que o sulfato está substituindo o cloreto em cloreto de sódio para formar sulfato de sódio enquanto o cloreto está substituindo o sulfato.
Embora ambas as formas sejam igualmente aceitáveis, a primeira é mais comum que a segunda.
- Reação entre ácido sulfúrico e hidróxido de potássio
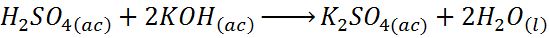
A reação entre ácido sulfúrico e hidróxido de potássio é uma reação de neutralização baseada em ácido base, mas também é uma reação de deslocamento duplo.
Nesse caso, o hidrogênio está substituindo o potássio em hidróxido de potássio para formar água, enquanto o potássio substitui o hidrogênio no ácido sulfúrico para formar sulfato de potássio.

