Estrutura de rádio, propriedades, usos, obtenção
- 1474
- 256
- Pete Wuckert
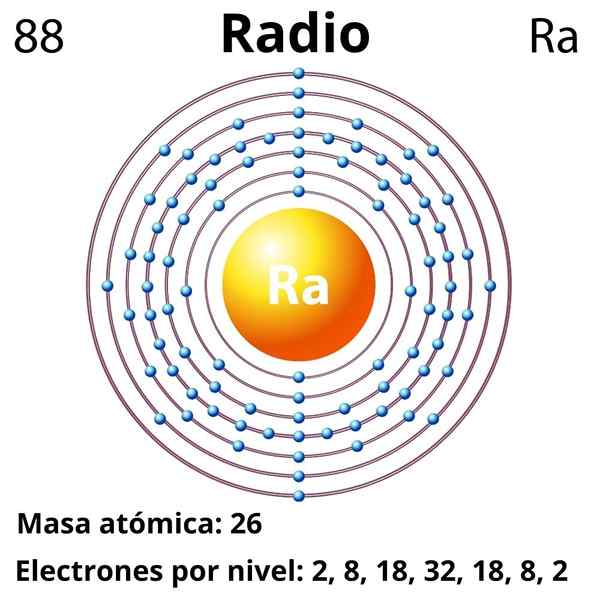
Ele rádio É um elemento metálico pertencente ao Grupo 2 da Tabela Periódica, os metais alcalinotherrosos, cujo símbolo químico é AR. É o último membro deste grupo, localizado abaixo do bário, e precedindo elementos radioativos como tório e urânio; No entanto, o raio é cerca de um milhão de vezes mais radioativo e, portanto, mais perigoso que o próprio urânio.
É um elemento cercado por histórias incríveis e infelizes, tudo como resultado da ignorância de seus efeitos negativos na saúde. O brilho azulado de seus sais e soluções aquosas cativou os cientistas Pierre e Marie Curie, que o descobriram no ano de 1898, analisando uma radiação inexplicável e forte a partir de amostras do minério de Pechblenda, ao qual seu urânio e urânio teriam removido seu teor de urânio e polônio.
 Ilustração de Marie Curie, descoberta do rádio
Ilustração de Marie Curie, descoberta do rádio Eliminou urânio e polônio, o Curie e concluiu que havia outro elemento presente no Pechblenda, responsável pela forte radiação, que engenhosamente poderia quantificar. Esse novo elemento era quimicamente muito semelhante ao bário; No entanto, diferentemente de suas linhas verdes espectrais, as delas eram de uma cor carmina.
Assim, após o processamento, purificação e análise de toneladas de Pechblenda, eles obtiveram 0.1 mg de racl2. Até então, em 1902, eles já haviam determinado a massa atômica do rádio, cujo nome derivou da palavra latina 'raio', que significa 'raio'. O rádio é literalmente um elemento radiante.
Oito depois, em 1910, Marie Curie, juntamente com o químico francês André Louis Debierne, conseguiu isolar o raio em sua forma de metal pela Racl Electrolysis2 usando mercúrio. Nasceu a febre da pesquisa, que mais tarde se tornou uma sensação comercial, cultural e medicinal alarmante.
[TOC]
Estrutura
O rádio é um metal cujos átomos são muito volumosos. Uma conseqüência disso é que seus cristais são poucos densos (embora um pouco mais que os de Bario) e adotem uma estrutura cúbica centrada no corpo (BCC). Dessa estrutura, nenhuma outra alotrópia é relatada a outras temperaturas ou pressões.
Configuração eletronica

A configuração eletrônica para o rádio é a seguinte:
[RN] 7s2
Ele oxida com enorme facilidade para se tornar o RA do cátion2+, que é isoletrônico a nobre gás de radônio. Portanto, todos os compostos de raio contêm o cátion AR2+, estabelecer interações predominantemente iônicas; No entanto, estima-se que seja possível que, devido a efeitos relativísticos, possa formar links com um personagem covalente notável (RA-X).
Pode atendê -lo: benzoato de potássio: estrutura, propriedades, obtenção, usosPropriedades de rádio
 Amostra de composto de rádio
Amostra de composto de rádio Aparência física
O rádio é um metal branco prateado, que tinge imediatamente amarelo e escurece ao reagir com o nitrogênio do ar para formar seu nituro, RA3N2. Por ser tão difícil de manipular, existem poucas características físicas do raio que foram determinadas diretamente.
Número atômico
88
Massa molar
226.03 g/mol
Ponto de fusão
Cerca de 700 ºC. Essa magnitude não foi capaz de ser determinada exatamente.
Ponto de ebulição
O rádio ferve entre 1100 e 1700 ºC. Essa grande margem de imprecisão reflete, novamente, as complicações de manipular um metal tão instável.
Densidade
5.5 g/cm3
Calor de fusão
8.5 kJ/mol
Calor de vaporização
113 KJ/mol
Estado de oxidação
O rádio tem um único estado de oxidação +2.
Eletro-negatividade
0.9. Este valor corresponde fielmente ao forte caráter eletropositivo do raio.
Energias de ionização
Primeiro: 509.3 kJ/mol
Segundo: 979 KJ/mol/mol
Radioatividade
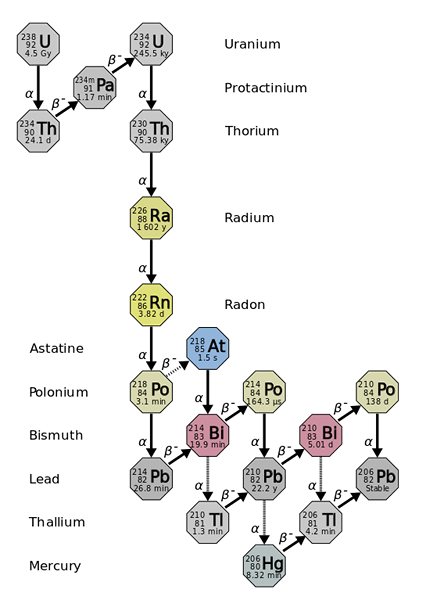 O raio deriva dos declínios radioativos de elementos mais pesados e mais instáveis, como no isótopo de urânio-238. Fonte: Usuário: Tosaka, CC por 3.0, via Wikimedia Commons
O raio deriva dos declínios radioativos de elementos mais pesados e mais instáveis, como no isótopo de urânio-238. Fonte: Usuário: Tosaka, CC por 3.0, via Wikimedia Commons O raio é cerca de um milhão de vezes mais radioativo que o urânio. Isso se deve principalmente ao fato de que outros isótopos são produzidos a partir dele, como 222RN (imagem superior), que por sua vez decai emitindo partículas α para se transformar no isótopo 218Po. Uma amostra de rádio, portanto, emite grandes quantidades de partículas α e β-, bem como raios γ.
Por exemplo, um grama de rádio, sofre 3.7 · 1010 Desintegrações por segundo, medida que serviu para definir a unidade de CI, chamada Curie. Esta energia é suficiente para aquecer uma amostra de 25 gramas de água 1 ° C por hora.
Se a cadeia de decaimento for observada, será visto que o isótopo inicial, o 238Você, você tem um t1/2 de 4.5 anos de giga (bilhões de anos); Enquanto, em vez disso, o 226RA tem um t1/2 1600 anos, que também produz isótopos com t1/2 de apenas dias, minutos e segundos.
A radioatividade do rádio e seus compostos é ionizante, de modo que substâncias fluorescentes, até os átomos circundantes, iluminam durante a noite, tornando -se capaz de desencadear reações explosivas. Esta propriedade é conhecida como radioluminescência.
Compostos e reatividade
Quando sais ou compostos de rádio são aquecidos em um isqueiro, eles disparam uma chama carmina. Esses sólidos geralmente são brancos ou incolores, mas são tingidos amarelos e finalmente escurecendo como resultado da radioatividade dos átomos de rádio. Se eles têm impurezas de bário, podem mostrar tons rosa.
Pode atendê -lo: reação de substituição duplaA química do rádio é muito semelhante à de Bario, como se fossem dois irmãos inseparáveis, ra-ba. Ambos formam os mesmos sais, insolúveis em água, com a diferença de que os do raio são um pouco mais insolúveis. Por exemplo, rádio sulfato, cetim4, É mais insolúvel que o sulfato de bário, Baso4; De fato, é o sulfato mais insolúvel já conhecido: 2.1 mg se dissolve apenas em 1 litro de água.
Por outro lado, hidróxido de rádio, ra (oh)2, É o mais solúvel e o básico de todos os hidróxidos de seus colegas.
Em solução, Ra Cation2+, Em vez de se comportar como os ácidos de Lewis, eles são básicos, pois seu tamanho grande torna impossível para as moléculas.
A analogia química entre o rádio e o bário retorna a este metal difícil de separar, porque seus sais coprecipam com os do bário.
Usos/aplicações de rádio
Relógios luminosos
 Os relógios luminosos e fosforescentes eram muito desejados no século XIX, por sua atratividade visual e por conter o rádio aclamado em suas pinturas. Fonte: Arma95, CC BY-SA 3.0, via Wikimedia Commons
Os relógios luminosos e fosforescentes eram muito desejados no século XIX, por sua atratividade visual e por conter o rádio aclamado em suas pinturas. Fonte: Arma95, CC BY-SA 3.0, via Wikimedia Commons O uso mais popular e controverso do raio deveria ser usado como um aditivo para as pinturas dos relógios. Seus átomos foram incorporados às formulações pastosas de sulfeto de zinco, Zns, que absorveram emissões radioativas para liberar uma luz verde e fosforescente. A tinta foi aplicada às mãos do relógio (imagem superior).
O problema desse uso estava na exposição radioativa contínua que afetou os usuários desses relógios; Ou pior, para os trabalhadores que os pintaram nas fábricas.
Em 1924, vários funcionários que trabalharam em uma indústria de pinturas, mais tarde conhecidos como The Radio Girls (Radium Girls), começaram a sofrer de câncer ósseo, deformações de suas mandíbulas e perdas de dentes, porque tiveram que lamber a ponta dos seus pincéis para serem Capaz de aplicar tinta radioativa nos relógios.
Isso, além da ignorância do raio, e a pouca ética de não impor medidas de proteção que garantissem a segurança dos trabalhadores, terminou em um escândalo legal que revolucionou as leis de segurança ocupacional.
Pode atendê -lo: alugar halogenuros: propriedades, obtenção, exemplosAs pinturas de rádio deixaram de ser fabricadas em 1960; Embora hoje existam vários espécimes colecionáveis que o têm em suas superfícies.
Raditor
 Radithor Bottle exibido no Museu Nacional de Ciência e História Nuclear, Novo México. Fonte: Sam Larussa dos Estados Unidos da América, CC BY-SA 2.0, via Wikimedia Commons
Radithor Bottle exibido no Museu Nacional de Ciência e História Nuclear, Novo México. Fonte: Sam Larussa dos Estados Unidos da América, CC BY-SA 2.0, via Wikimedia Commons O raditor era um dos muitos produtos farmacêuticos e cosméticos que proclamavam a eficiência do rádio para lutar por mil e um doente. Continha uma quantidade micrométrica de rádio, que, como deve curar todas as doenças digestivas e endócrinas. No entanto, em 1932, após a morte do Éden Byers, um de seus consumidores mais fervorosos, o raditor deixou o mercado.
Radioterapia
Nem todos os usos de rádio eram sensacionalistas, pseudocientíficos e sem escrúpulos (ou criminosos). Também havia realmente benéfico para a saúde, pelo menos até algum tempo. Sais de rádio, racl2 e rab2, Eles são usados no tratamento do câncer, especificamente o câncer de osso.
O isótopo 223RA, quando confundido por íons de cálcio no metabolismo, acaba destruindo células cancerígenas localizadas no osso.
No entanto, muitos dos usos terapêuticos do raio foram substituídos por isótopos mais seguros, econômicos e eficientes, como o 60Co and 137Cs.
Obtenção
O rádio é um dos elementos cuja produção é escassa: apenas 100 gramas por ano em todo o mundo. Toneladas de laranja de urânio, como o minério de Pechblenda (ou uraninita) são processadas seguindo o método Curie, que consiste no tratamento de amostras com hidróxido de sódio, ácido clorídrico e carbonato de sódio, de modo que uma mistura de rádio e sulfatos de bário, satin4-Baso4.
A mistura de cetim4-Baso4 Foi transformado em seus respectivos cloretos, racl2-Bacl2, separando os cátions ra2+ por cristalizações fracionárias e finalmente purificando técnicas de cromatografia iônica. O racl2 É reduzido por eletrólise ou reduzindo -o com alumínio de metal a 1200 ºC.
Isótopos
Todos os isótopos de rádio são radioativos. Quatro deles existem na natureza como produtos da decaimento radioativo de átomos de 232º, 235U e 238OU.
Esses quatro isótopos são: 223RA (t1/2= 11.4 dias), 224RA (t1/2= 3.64 dias), 226RA (t1/2= 1600 anos) e 228RA (5.75 anos). Obviamente, quase todos os átomos de rádio consistem em misturas de isótopos 226Ra e 228RA, porque outros se desintegram rapidamente.
Ele 226RA é o mais estável de todos os isótopos do rádio, todos os outros sendo muito instáveis, com t1/2 Menos de duas horas.
Referências
- Shiver & Atkins. (2008). Química Inorgânica. (quarta edição). Mc Graw Hill.
- Wikipedia. (2020). Rádio. Recuperado de: em.Wikipedia.org
- Os editores da Enyclopaedia Britannica. (2020). Rádio. Recuperado de: Britannica.com
- Radioatividade. (s.F.). Radium: o núcleo radioativo que fez história. Recuperado de: radioatividade.UE.com
- Cantrill, v. (2018). As realidades do rádio. Nature Chem 10, 898. doi.org/10.1038/S41557-018-0114-8
- Elsevier b.V. (2020). Rádio. Cientedirect. Recuperado de: ScientEdirect.com
- « Fatores de erosão eólica, tipos, consequências, exemplos
- Geografia da Península Itálica, países, flora, fauna, clima »

