Quais são o ânodo e cátodo?

- 1809
- 242
- Dennis Heidenreich
Ele ânodo e cátodo Eles são os tipos de eletrodos encontrados em células eletroquímicas. Estes são dispositivos capazes de produzir eletricidade através de uma reação química. As células eletroquímicas mais usadas são baterias.
Existem dois tipos de células eletroquímicas, células eletrolíticas e células galvânicas ou voltaicas. Nas células eletrolíticas, a reação química produzida pela energia não acontece espontaneamente, mas a corrente elétrica é transformada em uma reação de oxidação química.

A célula galvânica é composta de dois semi -lodgs. Estes são conectados por dois elementos, um motorista metálico e uma ponte salina.
O condutor elétrico, conforme indicado por seu nome, lidera a eletricidade porque ele tem muito pouca resistência ao movimento da carga elétrica. Os melhores motoristas geralmente são metais.
A ponte salina é um tubo que conecta os dois semi -ladrões, mantendo seu contato elétrico e sem deixar os componentes de cada célula se juntarem.Cada semi -media da célula galvânica contém um eletrodo e um eletrólito.
Quando a reação química ocorre, um dos semi -ladrões perde elétrons para o seu eletrodo, através do processo de oxidação; Enquanto o outro ganha elétrons para eletrodo, através do processo de redução.
Os processos de oxidação são produzidos no ânodo, e os processos de redução no cátodo
[TOC]
Ânodo
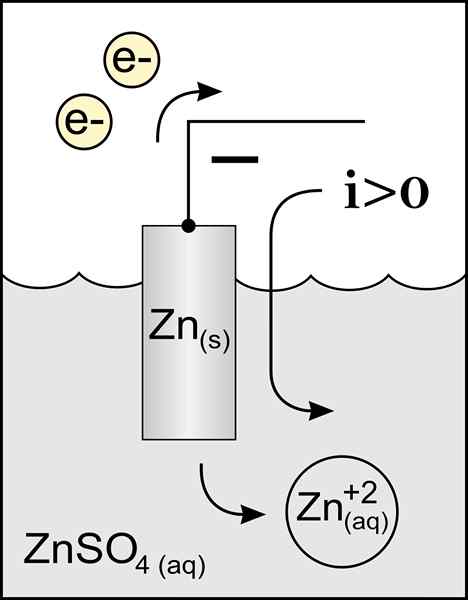 Diagrama de um ânodo de zinco em uma célula voltaica. Fonte: Trabalho original: Arquivo: ânodo de zinco 2.PNG por Usuário: Micheljullian (Talk) Trabalho derivado: KES47/CC BY-S (http: // criativecommons.Org/licenças/BY-SA/3.0/)
Diagrama de um ânodo de zinco em uma célula voltaica. Fonte: Trabalho original: Arquivo: ânodo de zinco 2.PNG por Usuário: Micheljullian (Talk) Trabalho derivado: KES47/CC BY-S (http: // criativecommons.Org/licenças/BY-SA/3.0/) O nome do ânodo vem do grego ανά (aná): up, e οδός (odós): caminho. Faraday foi quem cunhou esse termo no século XIX.
O melhor ânodo definidor é o eletrodo que perde elétrons em uma reação de oxidação. Normalmente está ligado ao pólo positivo do trânsito da corrente elétrica, mas nem sempre é o caso.
Pode atendê -lo: soluções valorizadasEmbora nas baterias o ânodo seja o poste positivo, nas luzes LED, é o oposto, o ânodo é o poste negativo.
Normalmente, a sensação de corrente elétrica é definida, apreciando -a como uma sensação de cargas livres, mas se o motorista não for metálico, as cargas positivas produzidas serão transferidas para o driver externo.
Esse movimento implica que temos cargas positivas e negativas que se movem em sentidos opostos; portanto, diz -se que a direção da corrente é a rota das cargas positivas dos cátions que estão no ânodo em direção à carga negativa dos anodos do ânodos encontrados no cátodo.
Nas células galvânicas, com um condutor metálico, a corrente gerada na reação segue o caminho do pólo positivo para o negativo.
Mas em células eletrolíticas, não tendo um condutor metálico, mas um eletrólito, íons com carga positiva e negativa que se movem em sentidos opostos podem ser encontrados.
Ânodos termoiônicos recebem a maioria dos elétrons que vêm do cátodo, aquecem o ânodo e precisam encontrar uma maneira de se dissipar. Este calor é gerado na tensão que ocorre entre elétrons.
Ânodos especiais
Existe um tipo de ânodos especiais, como os de X -Rains. Nestes tubos, a energia produzida pelos elétrons, além de produzir raios X, gera grande energia que aquece o ânodo.
Este calor ocorre com a tensão diferente entre os dois eletrodos e que exerce pressão sobre elétrons. Quando os elétrons se movem na corrente elétrica, eles atingem o ânodo transmitindo seu calor.
Pode servir a você: Equação de Henderson-Haselbalch: Explicação, Exemplos, ExercícioCátodo
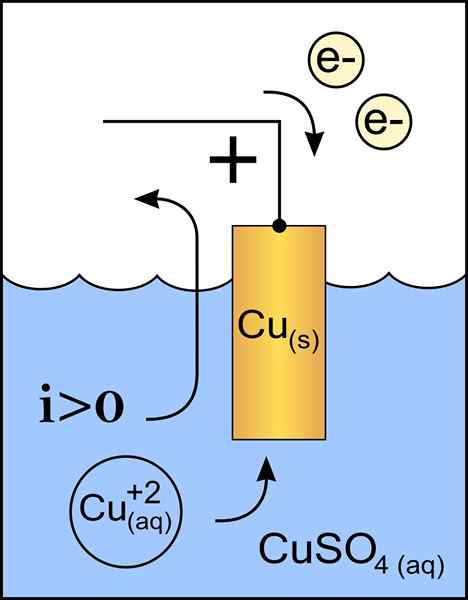 Diagrama de cátodo de cobre em uma célula voltaica. Fonte: Trabalho original: Arquivo: ânodo de zinco 2.PNG por Usuário: Micheljullian (Talk) Trabalho derivado: KES47/CC BY-S (http: // criativecommons.Org/licenças/BY-SA/3.0/)
Diagrama de cátodo de cobre em uma célula voltaica. Fonte: Trabalho original: Arquivo: ânodo de zinco 2.PNG por Usuário: Micheljullian (Talk) Trabalho derivado: KES47/CC BY-S (http: // criativecommons.Org/licenças/BY-SA/3.0/) O cátodo é o eletrodo com carga negativa, que na reação química sofre uma reação de redução, onde seu status de oxidação é reduzido quando recebe elétrons.
Assim como no ânodo, foi Faraday quem sugeriu o termo cátodo que vem do grego κατά [Catá]: 'Down' e ὁδός [Odós]: 'Road'. Para este eletrodo, a carga negativa foi atribuída ao longo do tempo.
Essa abordagem era falsa, pois dependendo do dispositivo em que está localizado, tem uma carga ou outra.
Essa relação com o pólo negativo, como no ânodo, surge da suposição de que a corrente flui do pólo positivo para o negativo. Isso surge dentro de uma célula galvânica.
Dentro das células eletrolíticas, o meio de transferência de energia, pois não está em um metal, mas em um eletrólito, pode coexistir íons negativos e positivos que se movem em sentidos opostos. Mas por acordo, diz -se que a corrente vai do ânodo ao cátodo.
Catodes especiais
Um tipo de catodos específicos são cátodos termiônicos. Nestes, o cátodo emite elétrons devido ao efeito do calor.
Nas válvulas termiônicas, o cátodo pode se aquecer circulando uma corrente de aquecimento em um filamento que o acoplou a.
Reação do equilíbrio
Se tomarmos uma célula galvânica, que é a célula eletroquímica mais comum, podemos formular a reação de equilíbrio que é gerada.
Cada semi -media que forma a célula galvânica, tem uma tensão característica conhecida como potencial de redução. Dentro de cada semi -media, há uma reação de oxidação entre os diferentes íons.
Pode atendê -lo: espectro de absorçãoQuando essa reação atinge um equilíbrio, a célula não pode fornecer mais tensão. Neste momento, a oxidação que está ocorrendo na semi -media daquele momento terá um valor positivo que o mais próximo é o equilíbrio. O potencial da reação será maior quanto mais equilíbrio é alcançado.
Quando o ânodo está em equilíbrio, ele começa a perder elétrons que passam pelo motorista para o cátodo.
No cátodo, a reação de redução está ocorrendo, quanto mais o melhor equilíbrio terá a reação ao produzir e pegar os elétrons que vêm do ânodo.
Referências
- Huheey, James e., et al.Química inorgânica: princípios de estrutura e reatividade. Pearson Education India, 2006.
- Sienko, Michell J.; Robert, a.Química: princípios e propriedades. Nova York, EUA: McGraw-Hill, 1966.
- Brady, James e.Química Geral: Princípios e Estrutura. Wiley, 1990.
- Petrucci, Ralph H., et al.Química Geral. Fundo Educacional Inter -Americano, 1977.
- Masterton, William L.; Hurley, Cecile n.Química: princípios e reações. Cengage Learning, 2015.
- Charlot, Gaston; Tremillon, Bernard; Lambling Badoz, J. Reações eletroquímicas. Toray-Masson, 1969.
- « As 10 contribuições e invenções mais importantes
- Características quetzais, habitat, reprodução, alimentos »

