O que é periodicidade química?
- 2341
- 624
- Dennis Heidenreich
O Periodicidade química É uma tendência ou padrão que exibe os elementos químicos para um conjunto de suas propriedades químicas e físicas. Torna -se um tipo de parentesco, que era um guia fundamental para os pais de química organizarem e classificarem todos os elementos da tabela periódica conhecida de hoje.
Os 118 elementos existentes (entre natural e artificial) mantêm, em uma extensão diferente, um relacionamento entre si que os define em famílias ou grupos. A princípio, isso permitiu descrever as reatividades dos elementos, bem como o tipo de compostos que se formam; E ainda melhor, preveja as propriedades daqueles que ainda não haviam sido descobertos.
 Os elementos da tabela periódica
Os elementos da tabela periódica Então, enquanto o século XX e a física progrediam, essas propriedades foram correlacionadas com a estrutura eletrônica do átomo. Assim, os elétrons marcam a periodicidade química em relação aos elementos, mas não tanto por seus isótopos e estabilidade relativa.
Graças à periodicidade química, é possível entender por que os elementos estão posicionados no mesmo grupo na tabela periódica. Também permite a previsão de propriedades químicas e até físicas, entre elementos de diferentes massas atômicas.
[TOC]
Padrões e grupos
 Como os padrões em zigue -zague dessas nuvens, as propriedades dos elementos mostram uma tendência periódica e característica. Fonte: Pravin Bagga/CC BY-S (https: // criativeCommons.Org/licenças/BY-SA/3.0)
Como os padrões em zigue -zague dessas nuvens, as propriedades dos elementos mostram uma tendência periódica e característica. Fonte: Pravin Bagga/CC BY-S (https: // criativeCommons.Org/licenças/BY-SA/3.0) Periodicidade química é observada, como esperado, em propriedades periódicas. Estes são caracterizados pela tendência de seus valores, pois são avaliados por um período ou grupo periódico.
Um zigue -zague, uma serra ou uma montanha íngreme pode ser escolhida para fins de comparação: com altos e baixos. Isto é, as propriedades periódicas variam com mínimo e máximo para certos elementos. E as posições relativas desses elementos correspondem, brilhantemente, com a localização em seus respectivos grupos.
É por isso que a periodicidade química é útil para analisá -la com base em grupos; No entanto, períodos são essenciais para uma visão completa da tendência.
Pode atendê -lo: carbonato de potássio (K2CO3): estrutura, propriedades, usos, obtençãoSerá visto com os seguintes exemplos de periodicidade em química, que não apenas ganham nas propriedades periódicas, mas também nos compostos inorgânicos e, inclusivos, orgânicos.
Energia de ionização
A energia de ionização, é, é uma das propriedades periódicas mais destacadas. Quanto maior o átomo de um elemento, mais fácil de seus elétrons será remover; isto é, os de Valência. Portanto: átomos com pequenos rádios terão grandes, enquanto átomos com rádios grandes, eles terão pequenos.
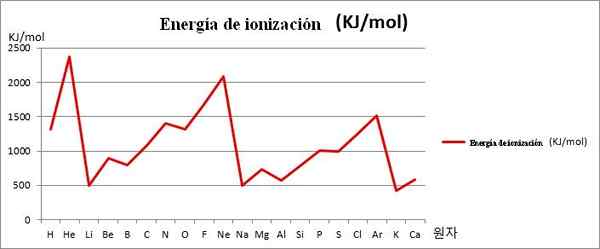 EI vs. gráficos. Os 20 primeiros elementos químicos. Fonte: Kenneth.JH.Han/CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/3.0)
EI vs. gráficos. Os 20 primeiros elementos químicos. Fonte: Kenneth.JH.Han/CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/3.0) Observe, por exemplo, na imagem acima, que os elementos Li, Na e K têm os menores EI, e é por isso que eles estão localizados nos vales ou fundos dos gráficos. Enquanto isso, os elementos que ele, NE e AR, são encontrados nos cúpulas ou pontos mais altos, uma vez que são muito grandes em relação aos outros elementos.
Os elementos Li, Na e K pertencem ao grupo de metais alcalinos, caracterizados por suas vítimas de EI. Por outro.
Assim, a periodicidade química indica que diminui um grupo, mas aumenta a turnê de um período da esquerda para a direita.
Bloqueio de hidros p
Um exemplo da periodicidade química fora das propriedades periódicas que vemos nos hidratantes dos elementos do bloco p.
Por exemplo, o grupo 15 é composto por elementos n, p, como, sb e bi. Se se sabe que a amônia, NH3, Possui nitrogênio com um número de oxidação de +3, então é possível esperar, por periodicidade simples, que os elementos restantes também tenham hidros semelhantes. E de fato é: NH3, Ph3, Cinzas3, Sbh3 e BI D3.
Pode atendê -lo: boro: história, propriedades, estrutura, usosOutro caso semelhante ocorre com o grupo 16. Hidreto de oxigênio é h2Ou, água. Espera -se, novamente, que os elementos S, SE, TE e PO tenham hidratantes com fórmulas iguais, mas com propriedades abismalmente diferentes. E isso é: H2S, h2SE, h2Te e h2Po. Isto é devido à periodicidade química.
Talvez o exemplo mais impressionante seja entendido por hidros de carbono, silício e germânio. Hidreto de carbono é CHO4, E o de silício, Sih4. O Germanio, previsto por Mendeleev com o nome de Eka-Silicio (s), deve ter como periodicidade um hidreto com fórmula GEH4; Previsão que acabou confirmando após sua descoberta e estudos subsequentes.
Moléculas de halogênio
Se se sabe que o flúor está no estado elementar como uma molécula M2, Então é assumido que os outros halogênios (Cl, Br, I e AT) também estão formando moléculas diatômicas. E ou seja, sendo as moléculas CL2, Br2 e eu2 O mais conhecido.
Óxidos e sulfetos
Da mesma forma como mencionado com hidroros de bloco p, Óxidos e sulfetos para elementos do mesmo grupo mostram um tipo de correspondência em suas respectivas fórmulas químicas. Por exemplo, o óxido de lítio é li2Ou, sendo óxidos para outros metais alcalinos ou grupo 1: NA2OK2Ou, RB2O e cs2QUALQUER.
Isso ocorre porque em todos eles os metais com um número de oxidação de +1, interagindo com um ânion ou2-. O mesmo acontece com seus sulfídios: li2S, NA2S, etc. No caso de metais alcalinoterrosos ou grupo 2, as fórmulas de seus óxidos e sulfetos são, respectivamente: abelha e bes, MGO e MGS, CAO e CAS, SRO e SRS, BAO e BAS.
Pode atendê -lo: ácido selenário (H2SO3): propriedades, riscos e usosEssa periodicidade também se aplica (em parte) para os óxidos dos elementos do bloco p: Co2, SiO2, Geo2, B2QUALQUER3, Para o2QUALQUER3, Ga2QUALQUER3, etc. No entanto, para elementos de bloco d ou outros do bloco p, Essa periodicidade se torna mais complicada devido aos mais altos números de oxidação possíveis para o mesmo elemento.
Por exemplo, cobre e prata pertencem ao grupo 11. Um tem dois óxidos: Cuo (Cu2+) e cu2Ou (cu+); Enquanto o outro mal tem apenas um: atrás (AG+).
Hidrocarbonetos e silanos
Tanto o carbono quanto o silício têm a capacidade de formar ligações C-C ou Si-Si, respectivamente. As ligações C-C são muito mais estáveis, portanto, as estruturas de hidrocarbonetos podem se tornar desproporcionalmente mais numerosas e variadas do que as de seus colegas de siltão.
Esta conclusão é devida novamente à periodicidade química. Por exemplo, etano, Cho3CH3 ou c2H6 O DISILANUM tem sua contraparte, SIH3Se H3 ou sim2H6.
Referências
- Whitten, Davis, Peck e Stanley. (2008). Química. (8ª ed.). Cengage Learning.
- Shiver & Atkins. (2008). Química Inorgânica. (Quarta edição). Mc Graw Hill.
- Helmestine, Anne Marie, Ph.D. (26 de agosto de 2020). Definição de Periódia em Química. Recuperado de: pensamento.com
- E. V. Babaev, & Ray Hefferlin. (s.F.). Conceito de periodicidade química:
De MEndeleev Molecular Table Hyper-Periodity Patterns. Recuperado de: química.MSU.Ru - Flores p., Theopold k., & Langley r. (s.F.). Periódia. Química Librettexts. Recuperado de: química.Librettexts.org
- A universidade aberta. (2020). Padrões químicos podem ser encontrados na tabela de período: periodicidade química. Recuperado de: aberto.Edu
- « Conceito de equilíbrio estável e exemplos
- História da sociologia rural, campo de estudo, importância »

