Características de prolina, estrutura, funções, alimentos
- 812
- 129
- Pete Wuckert
O Prolina (Pro, p) pertence aos 22 aminoácidos classificados como básicos. É um aminoácido não essencial, pois pode ser sintetizado pelo homem e outros animais de mamíferos.
Em 1900, o cientista alemão Richard Willstatter foi o primeiro a extrair e observar a prolina. No entanto, foi Emili Fischer, em 1901, que cunhou o termo "prolina" baseado no anel pirrolidina do aminoácido; Este pesquisador também conseguiu explicar em detalhes a síntese da prolina da caseína do leite.
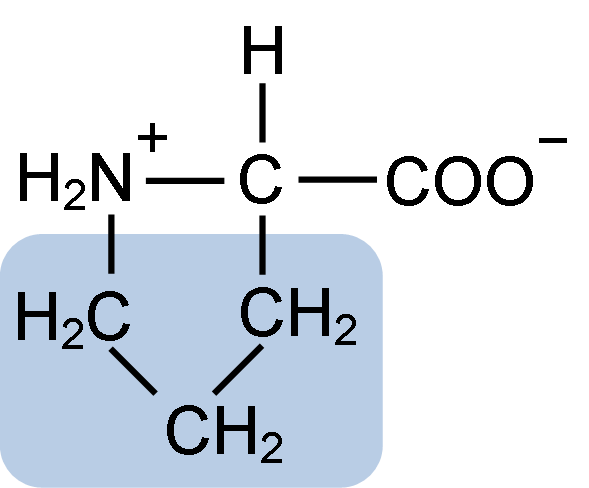
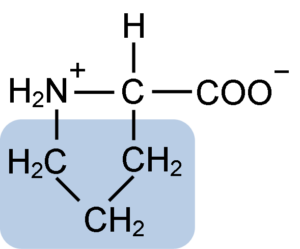 Estrutura química do aminoácido prolina (fonte: clavecina [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)] via Wikimedia Commons)
Estrutura química do aminoácido prolina (fonte: clavecina [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)] via Wikimedia Commons) Em proteínas como a caseína, a prolina tem uma função indispensável em "turnos" e dobragem estrutural. Nesta proteína, a prolina é distribuída homogeneamente por toda a estrutura e liga a caseína β e a proteína αS1; Além disso, evita loops estruturais defeituosos ou dobragem.
Nas análises bioquímicas usadas atualmente para determinar a sequência exata de aminoácidos que compõem as proteínas, a prolina é um dos aminoácidos de detecção mais difícil, uma vez que o grupo amino secundário da prolina tem um comportamento diferente e não pode ser facilmente detectado.
Scurvy é talvez a doença mais conhecida relacionada à prolina. Tem a ver com uma deficiência na ingestão de vitamina C, que afeta diretamente a hidroxilação da prolina nas fibras de colágeno, o que causa enfraquecimento sistêmico devido à instabilidade das fibras de colágeno que estão em todo o corpo.
[TOC]
Caracteristicas
O grupo amino secundário de carbono α dificulta a tarefa de classificação da prolina um pouco. No entanto, em alguns textos, isso é classificado ao lado dos aminoácidos ramificados ou com cadeias laterais alifáticas, uma vez que a cadeia lateral ou r r da prolina é hidrofóbica ou alifática.
Uma das características mais importantes da prolina é que, em nenhum caso.
Assim como todos os aminoácidos têm duas isoformas que dependem do átomo de carbono central, a prolina pode ser encontrada na natureza, como l-prolina ou como d-prolol. No entanto, o formul.
Nas proteínas em que está localizado, a prolina ocupa frequentemente locais próximos à superfície ou da dobra ou "virada" da cadeia polipeptídica, uma vez que a estrutura rígida e fechada da prolina faz uma forte interação com outra interação de aminoácidos difícil.
Estrutura
A prolina tem uma estrutura particular entre os aminoácidos básicos, pois apresenta um grupo amino (NH2) secundário e não o grupo amino primário que é característico de todos os aminoácidos.
Grupo R ou a cadeia lateral da prolina é um anel de pirrolidina ou tetra -hidropirrol. Este grupo é formado por uma amina heterocíclica (sem ligações duplas) de cinco átomos de carbono, onde cada um deles é saturado com átomos de hidrogênio.
A prolina tem a peculiaridade de que o átomo de carbono "central" está incluído no anel heterocíclico de pirolidina; portanto, os únicos átomos "livres" ou "pendentes" são o grupo carboxil (COOH) e o átomo de hidrogênio (H) do anel heterocíclico de o aminoácido.
Pode atendê -lo: superóxido dismutase: características, estrutura, funçõesA fórmula molecular da prolina é C5H9NO2 e seu nome IUPAC é pirrolidina-2-carboxílico ácido. Possui um peso molecular aproximado de 115,13 g/mol e sua frequência de aparência nas proteínas é de aproximadamente 7%.
Funções
As fibras de colágeno e tropocolágeno são as proteínas mais abundantes na maioria dos animais de vertebrados. Estes compõem a pele, tendões, matriz óssea e muitos outros tecidos.
As fibras de colágeno são compostas por muitos gatilhos triplos de polipeptídeos que, por sua vez, são compostos de múltiplos resíduos de prolina e glicina na sequência de glicina-pracracolina-prolina/hidroxiprololina (o último é um derivado modificado da prolina).
Em sua forma nativa, a prolina faz parte do procolágeno, sendo um precursor dos polipeptídeos do colágeno e algumas outras proteínas do tecido conjuntivo. A enzima prolina hidroxilase.
Qual é a principal função da prolina nas fibras de colágeno?
A hidroxiprolina fornece características de resistência ao colágeno, uma vez que esse derivado de aminoácidos tem a capacidade de formar um grande número de pontes de hidrogênio entre as cadeias triplas de hélice que compõem a proteína.
As enzimas que catalisam a hidroxilação do desperdício de prolina requerem a presença de vitamina C (ácido ascórbico) e, como mencionado acima, o escorbuto é devido ao enfraquecimento das fibras de colágeno devido a falhas na hidroxilação do resíduo da prolina, o que causa uma diminuição em diminuição pontes de hidrogênio que sustentam fibras de colágeno.
Outras funções
A prolina é indispensável para a formação de dobras e voltas de proteínas.
Sua estrutura fechada torna esse aminoácido difícil de "acomodar" as proteínas dentro, além disso, pois não pode formar pontes de hidrogênio para "interagir" com outros resíduos próximos, induz a formação de "turnos" ou "turnos" ao longo da estrutura das proteínas Onde ele é localizado.
Todas as proteínas com uma curta vida útil têm pelo menos uma região com prolina, glutamato, serina e treonina abundantes repetidas. Essas regiões passam de 12 a 60 resíduos e são chamadas de sequências de pragas.
As proteínas que contêm a sequência de pragas são marcadas pela ubiquitinação para a degradação subsequente em proteossomos.
Biossíntese
Muitos aminoácidos podem ser sintetizados a partir de intermediários de glicólise, do fosfato de pentose ou do ciclo do ácido cítrico (ciclo Krebs). Prolina e arginina são formadas nas rotas de glutamato curtas.
A rota biossintética virtualmente comum para todos os organismos vivos começa com a conversão de L-glutamato em γ-L-Glutamil-5-fosfato graças à ação da enzima glutamato-5-quinosa (em bactérias) ou pela γ-glutamil- Whinas (em humanos).
Essa reação implica fosforilação dependente de ATP; portanto, além do produto principal, uma molécula de ADP é gerada.
A reação catalisada por glutamato 5-Limid desidrogenase (em bactérias) ou pelo fosfato γ-glutamil redutase (em humanos) converte a γ-L-Glutamil-5-fosfato em L-glutamato-5-semid-limida-limida de presença de presença de Co -Factor Nadph.
Pode atendê -lo: meio stuart: fundação, preparação e usosO L-Glutamato-5-semialdeído é reversível e espontaneamente desidratado para (S) -1-1-pirrool), em cuja reação uma molécula de NADPH ou NADH também é necessária.
Degradação
Prolina, arginina, glutamina e histidina são constantemente degradadas para α-zetoglutarato para entrar no ciclo de ácido cítrico ou ciclo de Krebs. No caso particular da prolina, isso é oxidado pela primeira vez pela enzima prolina oxidase em pirrolina-5-carboxilato.
Na primeira etapa, onde ocorre a oxidação da prolina em pirrolina-5-carboxilato, os prótons destacados são aceitos pelo E-FAD, reduzindo o E-FADH2; Esta etapa é exclusiva para proline aminoácido.
Devido a uma reação espontânea, a pirrolina-5-carboxilato é transformada em glutamato γ-semialdeído, que serve como um substrato para a enzima glutamato γ-semi-limídica desidrogenase. Nesta etapa dois prótons emergem, um deles é aceito pelo NAD que é reduzido a NADH, e o outro é livre na forma de H+.
A arginina, como a prolina, é transformada em glutamato γ-semialdeído, mas através de uma rota metabólica alternativa na qual duas enzimas diferentes participam.
A γ-semialdeído glutamato enzima desidrogenase transforma o glutamato γ-semialdeído em L-Glutamato. Posteriormente, esse L-glutamato é oxidado novamente por uma enzima glutamato desidrogenase, que finalmente forma o α-zetoglutarato que será incorporado ao ciclo do ácido cítrico.
Na passagem de oxidação do glutamato, um próton (H+) é liberado e um grupo amino (NH3+). O próton reduz um grupo NADP+ e uma molécula NADPH se origina.
Apesar das numerosas semelhanças que existem entre as rotas de degradação e biossíntese da prolina e da arginina, esses aminoácidos são sintetizados e degradados por rotas totalmente opostas que usam enzimas diferentes, cofatores diferentes e que ocorrem diferentes compartimentos intracelulares.
Alimentos ricos em valina
Em geral, todos os alimentos com alto teor de proteína têm grandes quantidades de prolina. Entre eles estão carne, leite, ovos e outros. No entanto, quando nosso corpo está em um estado ideal de saúde e nutrição, é capaz de sintetizar a prolina endógena.
A prolina também pode ser encontrada em muitas legumes e nozes e em grãos integrais, como aveia, por exemplo. Outros alimentos proline são farelo de trigo, nozes, amêndoas, ervilhas, feijões, entre outros.
Algumas lojas naturistas geralmente formulam comprimidas dos aminoácidos L-Lisina e L-prolina combinados para ajudar as pessoas com problemas conjuntos ou para adiar o envelhecimento dos tecidos.
No entanto, não foi demonstrado com certeza que a ingestão de suplementos alimentares desses aminoácidos tem um efeito significativo no atraso da velhice ou em outras condições do avanço da idade.
Benefícios da sua ingestão
Dietas ricas em prolina são geralmente prescritas para pessoas que têm doenças articulares como artrite, entorses, quebra de ligamentos, deslocamentos, tendinite e outros, e isso se deve ao seu relacionamento com a síntese de fibras de colágeno presentes nos tecidos do corpo conjuntivo.
Pode atendê -lo: ágar m.R.S: O que é, base, preparação, usaMuitas das loções e comprimidos farmacológicos usados na indústria estética são enriquecidos com a prolina L, pois alguns estudos mostraram que esse aminoácido pode de alguma forma aumentar a síntese de colágeno e, portanto, melhorar a textura da pele, acelerar a cura das feridas, lacerações, úlceras e queimaduras.
Na indústria de alimentos, existem proteínas que têm "peptídeos bioativos" que exercitam funções além de suas propriedades nutricionais. Esses peptídeos geralmente têm dois a nove resíduos de aminoácidos, entre os quais prolina, arginina e lisina abundam.
Esses peptídeos bioativos podem ter atividade anti -hipertensiva com um certo efeito opióide; Eles podem atuar como imunomoduladores, estimulando a resposta imune contra alguns patógenos e podem até causar aumentos na vasoatividade, o que melhora a circulação daqueles que os consomem.
Distúrbios de deficiência
O glúten é uma proteína presente nos grãos de trigo que causa inflamação intestinal. As pessoas que sofrem de "intolerância ao glúten" são conhecidas como pacientes "celíacos" e sabe -se que essa proteína é rica em prolina e glutamina, cuja degradação proteolítica é difícil para pessoas com tal condição.
Algumas doenças têm a ver com a má dobra de proteínas importantes e é muito comum que esses defeitos tenham a ver com isomerização Cis-Trans de amida links em resíduos de prolina, pois, diferentemente de outros links peptídicos nos quais o isômero Trans É muito favorecido, na prolina, está desfavorecido.
No desperdício de prolina, foi observado que há uma tendência significativa em relação à formação do isômero Cis primeiro do que o isômero Trans Nas amidas adjacentes para proline o desperdício, que pode gerar uma conformação "incorreta" de proteínas.
Distúrbios metabólicos
Assim como outros aminoácidos essenciais e não essenciais, os principais distúrbios patológicos relacionados à prolina precisam fazer, geralmente, com defeitos nas rotas de assimilação deste aminoácido.
A hiperprolinemia, por exemplo, é um caso típico de deficiência em uma das enzimas que participam da rota de degradação da prolina, especificamente na 1-pirolina-5-carboxilato desidrogenase, o que leva a um acúmulo de seu substrato, que finalmente inativo a rota.
Essa patologia é geralmente diagnosticada por alto teor de prolina no plasma sanguíneo e pela presença do metabolito 1-pirrololina-5-carboxilato na urina dos pacientes afetados afetados.
Os principais sintomas desta doença consistem em distúrbios neurológicos, doenças renais e perda de capacidade auditiva ou surdez. Outros casos mais graves incluem atraso mental grave e dificuldades psicomotoras marcantes.
Referências
- Abu-Baker, s. (2015). Revisão da bioquímica: conceitos e conexões
- Delauney, a. J., & Verma, D. P. S. (1993). Biossíntese prolina e osmorregulação em plantas. The Plant Journal, 4 (2), 215-223.
- Lista, b., Lerner, r. PARA., & Barbas, C. F. (2000). Reações assimétricas de aldol direto catalisadas por prolina. Jornal da American Chemical Society, 122 (10), 2395-2396
- Nelson, d. eu., Lehninger, a. eu., & Cox, M. M. (2008). Lehninger Principles of Biochemistry. Macmillan.
- Plimmer, r. H. PARA. (1912). A constituição química das proteínas (vol. 1). Longmans, verde.
- Szabados, l., & Savouré, para. (2010). Prolina: um aminoácido multifuncional. Trends in Plant Science, 15 (2), 89-97.
- « Método Tachtenberg O que é, exemplos
- Características de Typtofano, estrutura, funções, benefícios »

