Características de Typtofano, estrutura, funções, benefícios
- 2588
- 741
- Ralph Kohler
Ele Triptofano (TRP, W) é um aminoácido classificado dentro do grupo de aminoácidos essenciais, uma vez que o organismo humano não pode sintetizá -lo e deve obtê -lo através da dieta.
Alguns alimentos como leite e seus derivados, carnes, ovos e alguns cereais, como quinoa e soja, contêm aminoácidos essenciais e, portanto, são uma fonte importante de triptofano.
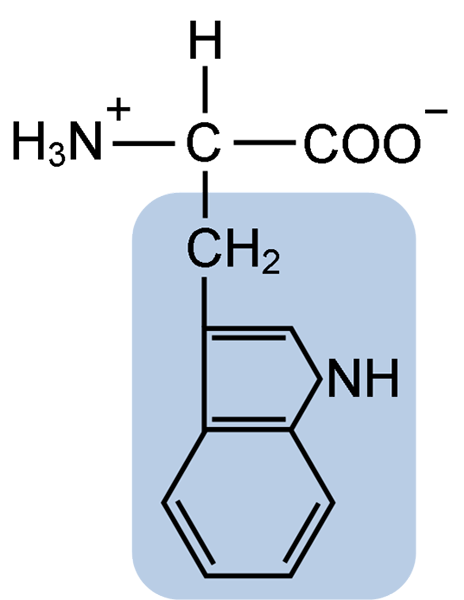
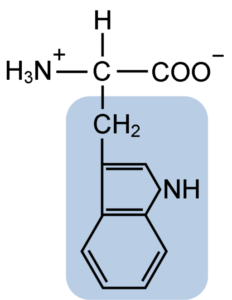 Estrutura química do aminoácido Typtofano (Fonte: Clavecina [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)] via Wikimedia Commons)
Estrutura química do aminoácido Typtofano (Fonte: Clavecina [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)] via Wikimedia Commons) Na natureza, mais de 300 aminoácidos diferentes são conhecidos e apenas 22 constituem as unidades monoméricas das proteínas celulares. Entre os últimos, 9 são aminoácidos essenciais, incluindo o triptofano, no entanto, a essencialidade de cada um difere entre uma espécie e outra.
O triptofano tem várias funções, entre as quais sua participação na síntese de proteínas, na síntese de serotonina, que é um poderoso vasoconstritivo e neurotransmissor, de melatonina e na síntese do co -fundador NAD.
No reino vegetal, o triptofano é um precursor fundamental do hormônio vegetal conhecido como auxina (ácido indol-3-acético). Pode ser sintetizado por algumas bactérias, como E. coli Do corismato, que é produzido a partir de alguns derivados glicolíticos, como fosfoenolpiruvato e erythrosa-4-fosfato.
Sua degradação em mamíferos ocorre no fígado, onde é usado para a síntese da acetil coenzima A (acetil-CoA), e por esse motivo é descrito como um aminoácido chama de glucogênico, pois pode entrar no ciclo de formação de glicose.
Vários estudos foram relatados com resultados controversos relacionados ao uso de triptofano como um suplemento alimentar para o tratamento de algumas patologias como depressão e alguns distúrbios do sono, entre outros.
Existem algumas doenças relacionadas a defeitos congênitos no metabolismo de aminoácidos. No caso de Typtophan, a doença de Hartnup pode ser nomeada, devido à triptofano -2,3 -monoxigenase, uma doença hereditária recessiva que é caracterizada por retardo mental e alterações do tipo de pelagra do tipo de pele.
[TOC]
Caracteristicas
Juntamente com fenilalanina e tirosina, o triptofano é encontrado no grupo de aminoácidos aromáticos e hidrofóbicos.
No entanto, o triptofano é caracterizado por ser um aminoácido ligeiramente hidrofóbico desde sua cadeia lateral aromática, com grupos polares, atenua essa hidrofobicidade.
Para ter anéis combinados, eles têm uma forte absorção de luz na região do espectro próxima ao ultravioleta e essa característica é freqüentemente usada para a análise estrutural de proteínas.
Absorve a luz ultravioleta (entre 250 e 290 nm) e, embora esse aminoácido não seja muito abundante na estrutura da maioria das proteínas do corpo humano, sua presença representa uma importante contribuição para a capacidade de absorção de luz da luz na região da região do 280 nm da maioria das proteínas.
Os requisitos diários de triptofano diferem da idade. Em bebês entre 4 e 6 meses, o requisito médio é de cerca de 17 mg por quilograma de peso por dia; Em crianças de 10 a 12 anos, é 3,3 mg por quilograma de peso por dia e em adultos é 3,5 mg por quilograma de peso por dia.
O triptofano é absorvido pela rota intestinal e é um aminoácido cetogênico e glicogênico ao mesmo tempo.
Como é um precursor de serotonina, um importante neurotransmissor, o triptofano deve atingir o sistema nervoso central (SNC) e, para isso.
Pode atendê -lo: grande ágar: fundamento, preparação e usosEstrutura
O triptofano tem uma fórmula molecular C11H12N2O2 e este aminoácido essencial tem uma cadeia lateral aromática.
Como todos os aminoácidos, o triptofano possui um átomo de carbono α ligado a um grupo amino (NH2), um átomo de hidrogênio (H), um grupo carboxil (COOH) e uma cadeia lateral (r) formada por uma estrutura heterocíclica, o grupo indol.
Seu nome químico é o ácido 2-amino-3-propiônico, possui uma massa molecular de 204,23 g/mol. Sua solubilidade a 20 ° C é 1,06 g em 100 g de água e tem uma densidade de 1,34 g/cm3.
Funções
No ser humano, o triptofano é usado para a síntese de proteínas e é indispensável para a formação de serotonina (5-hidroxitriptamina) um poderoso vasoconstrtor, estimulando a contração lisa do músculo (especialmente no intestino delgado) e um neurotransmissor capacitado de gerar estimulação psiquiátrica, depressão combatida e regular a ansiedade.
O triptofano é um precursor na síntese de melatonina e, portanto, tem implicações nos ciclos de sono e vigília.
O referido aminoácido é usado como precursor de uma das três maneiras para a formação do cofator NAD, um cofator muito importante que participa de uma variedade de reações enzimáticas relacionadas a eventos de redução de óxido.
O triptofano e alguns de seus precursores são usados para a formação de um hormônio vegetal chamado auxin (ácido indol-3-ativo). Auxinas são hormônios vegetais que regulam o crescimento, desenvolvimento e muitas outras funções fisiológicas das plantas.
Biossíntese
Nos organismos capazes de sintetizá-lo, o esqueleto de carbono do triptofano deriva do fosfoenolpiruvato e eritrosa-4-fosfato. Estes, por sua vez, são formados a partir de um intermediário do ciclo Krebs: oxalacetato.
Fosfoenolpiruvato e eritroso-4-fosfato são usados para síntese de corismato em uma rota enzimática de sete. O fosfoenolpiruvato (PEP) é um produto da glicólise e do fosfato eritroso-4 da rota de fosfato de pentose.
Como é a rota de síntese corismato?
O primeiro passo dos sintomas de Corismato é a união do pep com o erythrosa-4-fosfato para formar 2-zo-3-Disoxxi-d-anabino-heptulosonato-7-fosfato (dahp) (dahp).
Esta reação é catalisada pela enzima 2-zo-3-dexxi-d-anabino-heptulosonato-7-fosfato sintase (dahp syntasa), que é inibida pelo corismato.
A segunda reação implica a ciclação do DAHP pela desidrocinato sintase, uma enzima que requer o NAD co -fator, que é reduzido durante essa reação; Como resultado, ocorre 5-dishidroquinato.
A terceira etapa desta rota implica a eliminação de uma molécula de água de 5-desidratinato, a reação catalisada pela enzima desidratase desidrochinate, cujo produto final corresponde ao 5-Dishydro Shikimato.
O grupo ceto desta molécula é reduzido a um grupo hidroxila e, como conseqüência, Shikimato é formado. A enzima que catalisa essa reação é o dependente dependente de Nadph.
A quinta etapa da rota implica a formação de shikimate de 5 fosfato e o consumo de uma molécula de ATP por uma enzima conhecida como quinase shikimato, responsável pela fosforilação da shikima na posição 5.
Posteriormente, a partir do shikimato de 5-fosfato e pela ação do 3-enlappiruvil shikimato-5-fosfato sintase, 3-enlappiruvil shikimato 5-fosfato é gerado. A enzima acima mencionada promove o deslocamento do grupo fosforil de uma segunda molécula de PEP pelo grupo hidroxila de carbono na posição 5 de shikimate de 5 fosfato.
Pode atendê -lo: por que é importante cuidar da biodiversidade?A sétima e a última reação são catalisadas pelo corismo sintase, que elimina o fosfato do 3-enlapado em shikimate 5-fosfato e o torna corismato.
No fungo N. Crassa, Um único complexo enzimático multifuncional catalisa cinco das sete reações dessa rota e esse complexo é adicionado três outras enzimas que acabam gerando triptofano.
Síntese de triptofano em bactérias
Em E. coli, A transformação do corismo do triptofano inclui uma rota enzimática adicional:
Primeiro, a enzima antranilato sintase converte o corismato em antranilato. Nesta reação, participa que uma molécula de glutamina participa, doada pelo grupo amino que se liga ao anel indol do triptofano e se torna glutamato.
O segundo passo é catalisado pela fosforribosil transferase antranilato. Nesta reação, uma molécula de pirofosfato do 5-fosforribosil-1-pirofosfato (PRPP) (PRPP) se move rica em energia, e o N- (5'-fosforribosil) é formado.
A terceira reação desta rota de síntese de triptofano implica a participação da enzima fosforribosil-isomerase. Aqui o N- (5'-forribosil) -Santranilato.
Posteriormente, o fosfato indol-3-glicerol é formado, em uma reação catalisada pela simpatia indol-3-glicerol sintase, onde uma molécula de CO2 e uma H2O são liberadas e o 1- (o-carboxifenilamina) -1-sexirribulossa 5-fosfato.
A última reação desta rota acaba formando triptofano quando a triptofano sintase catalis.
Degradação
Nos mamíferos, o triptofano é degradado no fígado para acetil-CoA em uma rota que envolve doze etapas enzimáticas: oito para alcançar α-zo-stogipate e mais 4 para converter o α-zo-dotadipato em acetil coenzima para.
A ordem de degradação até α-Cetoadipato é:
Typtophan → N-Quinurenina formil → quinurenina → 3-hidroxi quinurenina → 3-hidroxi-adnilato → ε-semialdeído 2-amino-3-muconcycix → ε-semialdehido α-amino-muconcycix amouz.
As enzimas que catalisam essas reações, respectivamente, são:
Typtofano 2-3-dioxigenase, formamidase quinurenina, monooxigenase dependente de Nadph Nadph dependente.
Depois que α-cetoadipato é gerado, a descarboxilação oxidativa é formada. Isso, por ß-oxidação, a forma de glutaconil-coa que perde um átomo de carbono de bicarbonato (HCO3-), ganha uma molécula de água e termina como crotonil-coa.
Crotonil-CoA, também para ß-oxidação, produz acetil-CoA. O referido acetil-CoA pode seguir várias maneiras, entre as quais a gliconeogênese, para formar glicose e o ciclo de Krebs, para formar ATP, conforme necessário, conforme necessário.
No entanto, essa molécula também pode ser direcionada para a formação de corpos de cetona, que podem finalmente ser usados como fonte de energia.
Alimentos ricos em triptofano
Carnes vermelhas em geral, frango e peixe (especialmente peixes azuis, como salmão e atum) são especialmente ricos em triptofano. O leite e seus derivados, ovos, especialmente a gema, também são alimentos com muito conteúdo de triptofano.
Outros alimentos que servem como uma fonte natural deste aminoácido são:
- Nozes como nozes, amêndoas, pistácios e anacardos, entre outros.
- Cereais de arroz.
- Grãos secos, como feijão, lentilhas, grão de bico, soja, quinoa, etc.
- Fermento de cerveja e feijão fresco, bananas e bananas, abacaxi ou ananá, abacate, ameixas, agrião, brócolis, espinafre e chocolate.
Pode servir a você: tubarão submarino: história, realidade ou ficção?Benefícios da sua ingestão
O consumo de tiptofano é absolutamente necessário para sintetizar todas as proteínas que o incluem em sua estrutura e, através de suas diferentes funções, permite regular os ciclos de humor, sono e vigília e uma grande variedade de processos bioquímicos nos quais o NAD participa.
Além dos efeitos conhecidos sobre o humor, a serotonina (derivada do triptofano) intervém em múltiplas funções cognitivas relacionadas à aprendizagem e memória que, portanto, também estão relacionadas ao triptofano.
Existem dados que mostram a relação entre humor, serotonina e eixo gastrointestinal cerebral como um sistema de influências bidirecionais entre centros emocionais e cognitivos cerebrais e função periférica do trato digestivo.
O uso como um suplemento alimentar para o tratamento de alguns distúrbios, especialmente aqueles relacionados ao sistema nervoso central, tem sido muito controverso porque seu transporte competitivo com aminoácidos neutros, muito mais abundante, torna difícil alcançar aumentos significativos e sustentados em triptofano após sua administração oral.
Apesar dessas controvérsias, seu uso foi postulado como um complemento em:
- Tratamento da dor
- Transtornos do sono
- Tratamento de depressão
- Tratamento de mania
- Redução do apetite
Distúrbios de deficiência
A eliminação central ou a falta de triptofano é acompanhada pela depressão, falhas na atenção, diminuição da memória, do sono e transtornos de ansiedade.
Em pacientes deprimidos e com tendências suicidas, foram encontradas alterações na concentração de sangue e líquido cefalorraquidiano. Além disso, alguns pacientes com anorexia nervosa mostram baixos níveis séricos de triptofano.
Alguns pacientes polírica, que perdem vitamina B6 e zinco, freqüentemente têm fobias e ansiedade e melhoram com suplementos alimentares ricos em triptofano.
A síndrome carcinóide é caracterizada pela presença de tumores intestinais que causam diarréia, doenças vasculares e broncoconstrição e está relacionado ao déficit de niacina e tripfane
Pelagra é uma condição patológica que é acompanhada por diarréia, demência, dermatite e pode causar morte, isso também é tratado com suplementos de niacina e triptofano.
A doença de Hartnup tem a fazer, entre algumas coisas, com um defeito no metabolismo de vários aminoácidos, incluindo triptofano.
No caso por déficit da enzima Typtofano -2,3-monoxigenase, esta é uma doença hereditária recessiva que é caracterizada por retardo mental e alterações na pele do tipo de pele.
Referências
- Halvorsen, k., & Halvorsen, S. (1963). Doença de Hartnup. Pediatria, 31(1), 29-38.
- Hood, s. D., Bell, c. J., Argyropoulos, s. V., & Nutt, D. J. (2016). Don's Panic. Um guia para a depleção de triptofano com provocação de ansiedade específica para distúrbios. Journal of Psychopharmacology, 30(11), 1137-140.
- Jenkins, t. PARA., Nguyen, J. C., Polglaze, k. E., & Bertrand, P. P. (2016). Influência de triptofano e serotonina no humor e cognição com um possível papel do eixo intestinal. Nutrientes, 8(1), 56.
- Kaye, w. H., Barbarich, n. C., Putnam, k., Gendall, k. PARA., Fernstrom, J., Fernstrom, m.,… & Kishore, um. (2003). Efeitos ansiolíticos da depleção aguda de triptofano na anorexia nervosa. Jornal Internacional de Distúrbios Alimentares, 33(3), 257-267.
- Murray, r. K., Granner, d. K., Mayes, p., & Rodwell, V. (2009). Bioquímica ilustrada de Harper. 28 (p. 588). Nova York: McGraw-Hill.
- Nelson, d. eu., Lehninger, a. eu., & Cox, M. M. (2008). Lehninger Principles of Biochemistry. Macmillan.
- « Características de prolina, estrutura, funções, alimentos
- Causas, sintomas e tratamento de catalaps »

