Processo isocórico
- 1172
- 50
- Alfred Kub
O que é um processo isocórico?
A Processo isocórico É qualquer processo termodinâmico no qual o volume permanece constante. Esses processos geralmente também recebem o nome de isométrico ou isovolumétrico. Em geral, um processo termodinâmico pode ocorrer sob pressão constante e é então chamado de isobárico.
Quando ocorre em temperatura constante, nesse caso, diz -se que é um processo isotérmico. Se não houver troca de calor entre o sistema e o meio ambiente, então se fala em adiabático. Por outro lado, quando há um volume constante, o processo gerado é chamado isocórico.

No caso do processo isocórico, pode-se afirmar que, nesses processos, o trabalho de volume de pressão é nulo, pois isso resulta da multiplicação da pressão pelo aumento do volume.
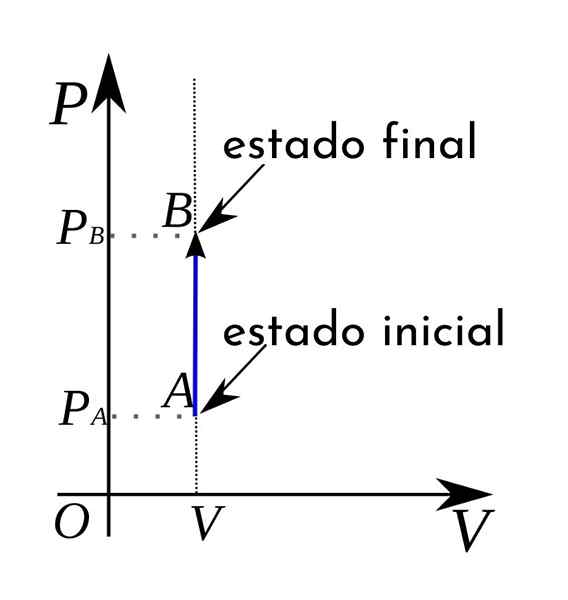
Além disso, em um diagrama termodinâmico de volume de pressão, os processos isocóricos são representados na forma de uma linha reta vertical.
Fórmulas e cálculo
O primeiro princípio da termodinâmica
Na termodinâmica, o trabalho é calculado a partir da seguinte expressão:
W = P ∙ ∆ V
Nesta expressão w é o trabalho medido em joules, p a pressão medida em Newton por metro quadrado e ∆ v é a variação ou aumento no volume medido em metros cúbicos.
Da mesma forma, o conhecido como o primeiro princípio da termodinâmica estabelece que:
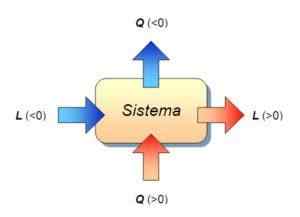
∆ u = q - w
Nesta fórmula, é o trabalho realizado pelo sistema ou no sistema, que é o calor recebido ou emitido pelo sistema, e ∆ u É a variação de energia interna do sistema. Nesta ocasião, as três magnitudes são medidas em Joules.
Como em um processo isocórico, o trabalho é zero, acontece que é cumprido que:
Pode atendê -lo: Netuno (planeta)∆ u = qV (desde, ∆ v = 0 e, portanto, w = 0)
Ou seja, a variação de energia interna do sistema se deve apenas à troca de calor entre o sistema e o ambiente. Nesse caso, o calor transferido é chamado de calor para o volume constante.
 Capacidade de calor em volume constante
Capacidade de calor em volume constante
A capacidade de calor de um corpo ou sistema resulta da divisão da quantidade de energia na forma de calor transferido para um corpo ou sistema em um determinado processo e a mudança de temperatura experimentada pela mesma.
Quando o processo é realizado em volume constante, é falado de capacidade de calor para o volume constante e é denotado por Cv (capacidade de calor molar).
Será cumprido nesse caso:
Qv = N ∙ cv ∙ ∆t
Nesta situação, n é o número de moles, cv É o molar de capacidade de calor acima mencionado para o volume constante e ∆T é o aumento da temperatura experimentado pelo corpo ou sistema.
Exemplos diários de processos isocóricos
É fácil imaginar um processo isocórico, é necessário apenas pensar em um processo que ocorre em volume constante; Ou seja, no qual o recipiente que contém o material ou sistema de material não altera o volume.
Um exemplo pode ser o caso (ideal) bloqueado em um recipiente fechado cujo volume não pode ser alterado por qualquer meio que seja fornecido calor. Suponha que o caso de um gás trancado em uma garrafa.
Ao transferir calor para o gás, como já explicado, ele acabará resultando em um aumento ou aumento em sua energia interna.
O processo reverso seria o de um gás fechado em um recipiente cujo volume não pode ser modificado. Se o gás esfriar e dar calor ao meio ambiente, a pressão do gás e o valor da energia interna do gás diminuiriam seria reduzida.
Pode servir a você: variável discreta: características e exemplosO ciclo ideal otto
O ciclo Otto é um caso ideal do ciclo usado por máquinas de gasolina. No entanto, seu uso inicial estava nas máquinas que usavam gás natural ou outros combustíveis em um estado gasoso.
De qualquer forma, o ciclo ideal de Otto é um exemplo interessante do processo isocórico. Ocorre quando em um carro de combustão interna, a combustão da mistura de gasolina e ar ocorre instantaneamente.
Nesse caso, ocorre um aumento na temperatura e pressão do gás dentro do cilindro, permanecendo o volume constante.
Exemplos práticos
Primeiro exemplo
Dado um gás (ideal) bloqueado em um cilindro fornecido com um pistão, indique se os seguintes casos são exemplos de processos isocóricos.
- Um trabalho de 500 J sobre gás é feito.
Nesse caso, não seria um processo isocórico, porque fazer um trabalho no gás é necessário comprimi -lo e, portanto, alterar seu volume.
- O gás expande horizontalmente o pistão.
Novamente, não seria um processo isocórico, pois a expansão do gás implica uma variação em seu volume.
- O pistão do cilindro é fixo para que o gás não possa ser movido e o gás seja resfriado.
Nesta ocasião, seria um processo isocórico, pois não haveria variação de volume.
Segundo exemplo
Determine a variação da energia interna que experimentará um gás contido em um recipiente com um volume de 10 L submetido a 1 atm de pressão, se sua temperatura subir de 34 ºC a 60 ° C em um processo isocórico, conhecido seu calor molar específico Cv = 2.5 ·R (ser R = 8.31 J/mol · k).
Pode servir a você: Graff Van Gerador: Partes, como funciona, aplicativosComo é um processo de volume constante, a variação interna de energia só ocorrerá como resultado do calor fornecido ao gás. Isso é determinado com a seguinte fórmula:
Qv = N ∙ cv ∙ ∆t
Para calcular o calor fornecido, é necessário primeiro calcular as toupeiras de gás contidas no recipiente. Para isso, é necessário recorrer à equação de gases ideais:
P ∙ v = n ∙ r ∙ t
Nesta equação n é o número de moles, r é uma constante cujo valor é 8,31 j/mol · k, t é a temperatura, p é a pressão à qual o gás medido em atmosferas e t é submetido e t é a temperatura medida em Kelvin.
É limpo e obtido:
n = r ∙ t/ (p ∙ v) = 0, 39 toupeiras
De modo que:
∆ u = qV = N ∙ cv ∙ ∆T = 0,39 ∙ 2,5 ∙ 8,31 ∙ 26 = 210,65 J

