Princípio de Le Châtelier

- 3865
- 52
- Alfred Kub
Qual é o princípio de Le Châtelier?
Ele Princípio de Le Châtelier É uma regra geral que prevê o efeito que os diferentes fatores que afetam o equilíbrio químico têm. Em particular, ajuda a prever em que direção uma reação que está em equilíbrio se moverá quando esse equilíbrio for perturbado por um agente externo.
Este princípio estabelece que:
"Quando um sistema que está em equilíbrio está sujeito a um distúrbio ou uma tensão externa, o sistema reage na direção que permite neutralizar parcialmente esse distúrbio".
A perturbação é bem compreendida:
- Uma mudança na concentração de qualquer um dos reagentes.
- Uma mudança na concentração de qualquer um dos produtos.
- Mudanças na pressão.
- Alterações no volume.
- Uma mudança de temperatura
Quando as mudanças ocorrem conforme as mencionadas, uma das duas reações, o direto ou o inverso, é favorecido em relação ao outro, de modo que o sistema reaja nesse sentido que se move em direção a um novo estado de equilíbrio.
Isso é semelhante aos ajustes feitos por um balanceador na corda bamba. Quando a gravidade hala de um lado, o balanceador reage movendo -se para o lado oposto. Dizemos que o equilíbrio dele se moveu, já que ele ainda está em equilíbrio (ele não cai), mas agora ele tem uma posição diferente.
Em seguida, veremos como o princípio de Le Châtelier é usado para prever a direção em que um sistema reagirá sofrendo diferentes tipos de tensões ou distúrbios, como: mudanças na concentração, volume, pressão e temperatura.
Efeito das mudanças na concentração
Suponha que tenhamos a seguinte reação em equilíbrio:
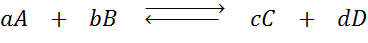
Se alterarmos a concentração de qualquer uma das espécies envolvidas (A, B, C ou D), o princípio de Le Châtelier prevê que o sistema reagirá para neutralizar essa mudança, ou consumindo o excesso adicionado ou recuperando a quantidade eliminada. 4 situações diferentes podem ser dadas:
1. Aumento da concentração de reagentes
Se aumentarmos a concentração de um reagente, por exemplo, para, de acordo com o princípio de Le Châtelier, o sistema reagirá para consumir o excesso adicionado. Isso significa que ele reagirá diretamente (da esquerda para a direita), uma vez que essa direção é consumida para.
Nesse caso, diz -se que a reação direta é favorecida e que o equilíbrio se moveu para os produtos, pois no novo equilíbrio a concentração de produtos é maior que a do saldo original.
Pode atendê -lo: separação magnética2. Aumento da concentração de produtos
Se aumentarmos a concentração de um produto, por exemplo, C, o sistema reagirá ao contrário de consumir o excesso C adicionado (isto é, da direita para a esquerda).
Nesse caso, diz -se que a reação reversa é favorecida e que o equilíbrio se move em direção aos reagentes.
3. Diminuição na concentração de reagentes
A diminuição da concentração tem o efeito oposto ao aumento da referida concentração. Se nos retirarmos do meio, reduzindo assim sua concentração, o sistema reagirá à esquerda (ao contrário) para neutralizar a mudança. O equilíbrio se move em direção aos reagentes.
4. Diminuição da concentração de produtos
Se diminuirmos a concentração de C ou D, o sistema reagirá diretamente para substituir a diminuição da concentração (isto é, da esquerda para a direita). O equilíbrio se move em direção aos produtos.
Exemplo:
Determine o efeito de adicionar mais íons tiocianos (SCN-) No equilíbrio químico a seguir, sabendo que o produto da direita é vermelho intenso e ferro (iii) é amarelo.
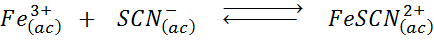
Solução: Nesse caso, estamos adicionando tiocianato que é um reagente, de modo que o equilíbrio deve se mover para a direita, aumentando a concentração do complexo e, portanto, a intensidade da cor vermelha na solução.
Efeito das mudanças no volume e pressão
Alterações no volume e pressão não afetam significativamente as reações em equilíbrio no estado líquido ou sólido, mas podem afetar as encontradas em um estado gasoso. Isso ocorre porque, para gases, a concentração é proporcional à pressão, como previsto pela lei ideal para gases.
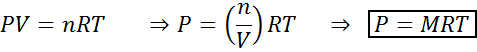
Aumentar a pressão de um gás que mantém a temperatura constante é equivalente a diminuir seu volume, de modo que o efeito de ambos os distúrbios será o mesmo.
Se uma pressão total aumentar para uma reação de equilíbrio em equilíbrio (ou diminuímos seu volume), o sistema reagirá tentando reduzir essa pressão novamente, para que o equilíbrio se mova para onde há uma quantidade menor de moléculas de partículas gasosas.
Pode atendê -lo: cromatografia em camada fina: características, para que é Na reação entre nitrogênio e hidrogênio para formar amônia, 4 moléculas de refrigerante são consumidas e apenas duas são produzidas; portanto, um aumento na pressão desloca o equilíbrio para a maior formação de amônia
Na reação entre nitrogênio e hidrogênio para formar amônia, 4 moléculas de refrigerante são consumidas e apenas duas são produzidas; portanto, um aumento na pressão desloca o equilíbrio para a maior formação de amônia Se na reação forem consumidos e o mesmo número de moléculas de gás for produzido, as alterações de volume e pressão não afetarão o equilíbrio.
Por outro lado, se apenas modificarmos a pressão parcial de qualquer um dos gases, o efeito é o mesmo que aumentar ou diminuir a concentração da referida espécie.
Exemplo:
Dada a reação de decomposição do tetróxido de dyitrogênio no equilíbrio:
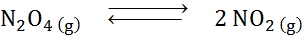
Determinar o efeito da redução do volume, aumentando a pressão.
Solução: Se aumentarmos a pressão total do sistema ou reduzirmos seu volume, o equilíbrio se move em direção aos reagentes, pois, nessa direção, há uma diminuição líquida nas moléculas de gás (2 e 1) são consumidas 1) que permite neutralizar o aumento da pressão.
Efeito das mudanças de temperatura
O efeito da temperatura no equilíbrio químico é diferente dos outros fatores que vimos até agora. Nos casos anteriores, um novo saldo é obtido após o distúrbio, mas a mesma constante de equilíbrio é mantida. No entanto, se a temperatura mudar, a constante de equilíbrio mudará.
Para saber como o equilíbrio constante muda com a temperatura, o sinal da entalpia da reação precisa ser conhecido:
- Se uma reação libera calor, ou seja, é exotérmica, sua entalpia é negativa e a constante de equilíbrio diminui à medida que a temperatura aumenta. Nesses casos, o equilíbrio se move na direção oposta em direção aos reagentes.
- Se uma reação absorve calor, isto é, é endotérmica, sua entalpia é positiva e o oposto acontece.
Lembrar o efeito da temperatura é fácil se considerarmos o calor como um reagente que ocorre no caso de reações exotérmicas e for consumido no caso de endotérmico. O aumento da temperatura seria como "adicionar" calor ao sistema e esfriar seria equivalente a removê -lo.
Portanto, se uma reação for exotérmica e a temperatura aumentar, seria como adicionar um produto da reação, de modo que o equilíbrio se move na direção oposta, em direção aos reagentes, e se esfriar o oposto.
Pode atendê -lo: ácido pícrico: o que é, estrutura, síntese, propriedadesPor outro lado, se uma reação for endotérmica e a temperatura aumentar, seria como adicionar um reagente, de modo que o equilíbrio se move em direção aos produtos, enquanto uma diminuição na temperatura tem o efeito oposto.
Exemplo:
A reação de decomposição de n2QUALQUER4 Tem uma entalpia de reação de +58,0 kJ/mol. Em que direção o equilíbrio se moverá se a temperatura for diminuída?
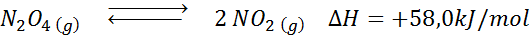
Solução: Como entalpia é positiva, a reação é endotérmica. Por esse motivo, o resfriamento favorecerá a reação reversa, e o equilíbrio se moverá em direção aos reagentes, isto é, para a formação de mais n2QUALQUER4.
Efeito de catalisadores, inibidores e substâncias inertes
Catalisadores e inibidores afetam a velocidade com que ocorrem reações, mas afetam a reação direta e indireta. Por esse motivo, eles não afetam o estado de equilíbrio.
Por outro lado, a adição de uma substância inerte como um gás que não reage com nenhum dos reagentes ou produtos, não afetará a reação direta ou direta, por isso terá nenhum efeito no equilíbrio.
Aplicação do princípio de Le Châtelier
Compreender esse princípio é muito útil, pois nos permite manipular o estado de equilíbrio de uma reação à nossa conveniência.
Nos casos em que estamos interessados.
Isso significa:
- Adicione grandes quantidades de reagentes, se estes forem econômicos.
- Retirar o produto à medida que a reação avança, a fim de manter o sistema em constante estado de tensão, sempre tentando alcançar o equilíbrio reagindo diretamente.
- Aumentar a temperatura no caso de reações endotérmicas.
- Aumentar a pressão sobre as reações em que mais moléculas de gase são consumidas do que ocorrem.
Também podemos querer minimizar a quantidade de um produto formado por uma reação indesejada. Nesses casos, fazemos o oposto.
Exemplo de aplicação do princípio de Le Châtelier
Na síntese orgânica, o princípio de Le Châtelier é constantemente usado para melhorar as reações dos reações.
Por exemplo, nas reações de desidratação de álcool, são adicionados dessecantes ao ambiente que absorve a água formada durante a reação. Isso reduz a concentração do referido produto, o que desloca o equilíbrio em relação aos produtos.

