Polaridade (química) o que é, definição, exemplos
- 2101
- 256
- Pete Wuckert
O que é polaridade química?
O Polaridade química É uma propriedade que é caracterizada pela presença de uma distribuição heterogênea acentuada de densidades eletrônicas em uma molécula. Em sua estrutura, portanto, existem regiões carregadas negativamente (Δ-) e outras carregadas positivamente (Δ+), gerando um momento dipolo.
O momento dipolar (µ) do link é uma forma de expressão da polaridade de uma molécula. Geralmente é representado como um vetor cuja origem está na carga (+) e sua extremidade está localizada na carga (-), embora alguns produtos químicos a representem em inverso.
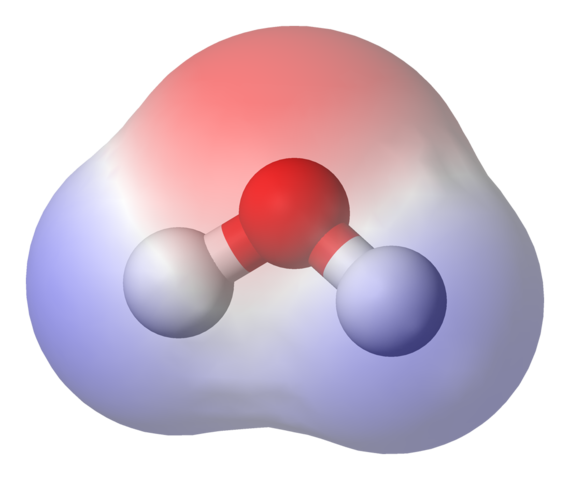
 Mapa potencial eletrostático para a molécula de água. Fonte: Benjah-BMM27 via Wikipedia.
Mapa potencial eletrostático para a molécula de água. Fonte: Benjah-BMM27 via Wikipedia. Na imagem superior, o mapa potencial eletrostático para a água é mostrado, h2QUALQUER. A região avermelhada (átomo de oxigênio) corresponde à de densidade eletrônica mais alta e também pode ser visto que se destaca nas regiões azuis (átomos de hidrogênio).
Como a distribuição da referida densidade eletrônica é heterogênea, diz -se que há um poste positivo e negativo. É por isso que falamos sobre a polaridade química e, no momento, dipolo.
Momento dipolar
O momento dipolo µ é definido pela seguinte equação:
µ = δ ·d
Onde δ é carga elétrica de cada pólo, positivo (+δ) ou negativo (-δ) e d É a distância entre eles.
O momento dipolar é geralmente expresso em Debye, representado pelo símbolo D. Um metrô Coulomb · é equivalente a 2.998 · 1029 D.
O valor do momento dipolo da ligação entre dois átomos diferentes está em relação à diferença nas eletronegatividades dos átomos que formam o link.
Para que uma molécula seja polar, não basta ter vínculos polares em sua estrutura, mas também deve ter geometria assimétrica; De tal maneira, isso impede que os momentos dipolares se anulem.
Pode atendê -lo: carbonoids: elementos, características e usosAssimetria na molécula de água
A molécula de água tem duas ligações O-H. A geometria da molécula é angular, isto é, com a forma de "V"; Portanto, os momentos dipolares dos links não se cancelam, mas a soma deles ocorre apontando para o átomo de oxigênio.
O mapa potencial eletrostático para H2Ou refletir isso.
Se a molécula angular H-O-H for observada, a seguinte pergunta pode surgir: é realmente assimétrico? Se for desenhado um eixo imaginário que atravessa o átomo de oxigênio, a molécula será dividida em duas metades iguais: h-o | o-h.
Mas, não é assim se o eixo imaginário é horizontal. Quando este eixo agora divide a molécula novamente em duas metades, o átomo de oxigênio terá, por um lado, e por outro os dois átomos de hidrogênio.
É por isso que a aparente simetria de H2Ou deixa de existir e, portanto, uma molécula assimétrica é considerada.
Moléculas polares
As moléculas polares devem atender a uma série de características, como:
-A distribuição de cargas elétricas na estrutura molecular é assimétrica.
-Eles geralmente são solúveis em água. Isso se deve entre as moléculas polares pode interagir pelas forças dipolo-dipolo, onde a água é caracterizada por ter um grande momento dipolar.
Além disso, sua constante dielétrica é muito alta (78,5), o que permite manter cargas elétricas separadas, aumentando sua solubilidade.
-Em geral, moléculas polares têm pontos de ebulição e fusão altos.
Essas forças são constituídas pela interação dipolo-dipolo, pelas forças dispersivas de Londres e pela formação de pontes de hidrogênio.
Pode servir a você: Sulfato de Ferro (FeSO4): O que é, estrutura, propriedades, síntese-Devido à sua carga elétrica, as moléculas polares podem gerar eletricidade.
Exemplos
SW2
Dióxido de enxofre (então2). O oxigênio tem uma eletronegatividade de 3,44, enquanto a eletronegatividade de enxofre é 2,58. Portanto, o oxigênio é mais eletronegativo que o enxofre. Existem dois links s+.
Por ser uma molécula angular com o S no vértice, os dois momentos dipolares são orientados na mesma direção; E, portanto, eles somam, fazendo com que a molécula2 seja polar.
Chcl3
Clorofórmio (hccl3). Há um link C-H e três links C-Cl.
A eletronegatividade de C é 2,55 e a eletronegatividade de H é 2.2. Assim, o carbono é mais eletronegativo que o hidrogênio; E, portanto, o momento dipolar será orientado de H (Δ+) para C (Δ-): Cδ--Hδ+.
No caso de links c-cl, o C possui uma eletronegatividade de 2,55, enquanto o CL possui uma eletronegatividade de 3,16. O momento dipolo ou dipolo é orientado do C para o CL nos três links C δ+-Cl δ-.
Quando há uma região pobre de elétrons, ao redor do átomo de hidrogênio, e uma região rica em elétrons composta pelos três átomos de cloro, o CHCL3 É considerado uma molécula polar.
HF
O fluoreto de hidrogênio tem apenas uma ligação H-F. A eletronegatividade de H é 2,22 e a eletronegatividade do F é 3,98. Portanto, o fluoreto termina com a maior densidade eletrônica, e a ligação entre os dois átomos é melhor descrita como: Hδ+-Fδ-.
Pode atendê -lo: hidróxido de alumínio: estrutura, propriedades, usos, riscosNH3
A amônia (NH3) tem três links n-h. A eletronegatividade do N é 3,06 e a eletronegatividade de H é 2,22. Nas três ligações, a densidade eletrônica é orientada para o nitrogênio, sendo ainda maior pela presença de um par de elétrons livres.
A molécula NH3 É tetraédrico, com o átomo de n ocupando o vértice. Os três momentos dipolares, correspondentes aos links N-H, são orientados na mesma direção. Neles, Δ- está localizado em n e Δ+ em h. Assim, os links são: nδ--Hδ+.
Esses momentos dipolares, a assimetria da molécula e o torque livre de elétrons em nitrogênio, tornam a amônia uma molécula altamente polar.
Macromoléculas com Heteroátomos
Quando as moléculas são muito grandes, não é mais precisa classificá -las como apolares ou polares em si mesmas. Isso ocorre porque pode haver partes de sua estrutura com as características apolares (hidrofóbicas), como as características polares (hidrofílicas).
Esses tipos de compostos são conhecidos como anfifilos ou anfipáticos. Como a parte apolar pode ser considerada pobre em elétrons em relação à parte polar, há uma polaridade presente na estrutura, e os compostos anfiprílicos são considerados compostos polares.
Pode -se esperar em geral que uma macromolécula com heteroátomos tenha momentos dipolares e, com ele, polaridade química.
Heteroácromos é entendido por aqueles que são diferentes daqueles que compõem o esqueleto da estrutura. Por exemplo, o esqueleto carbonatado é biologicamente o mais importante de todos, e o átomo com quem o carbono (além do hidrogênio) é chamado de heteroácomo.
Referências
- Compostos polares e não polares. St. Louis Community College. Recuperado de: usuários.STLCC.Edu
- Como explicar a polaridade. Cienting. Recuperado de: cienting.com

