Características, estrutura, funções, exemplos
- 932
- 151
- Lonnie MacGyver
As oxidorrereducases Eles são proteínas com atividade enzimática encarregada de catalisar as reações de redução da ferrugem, ou seja, reações que implicam a remoção de átomos de hidrogênio ou elétrons nos substratos sobre os quais eles agem.
As reações catalisadas por essas enzimas, como o nome indica, são reações de redução de óxido, ou seja, reações em que uma molécula doa elétrons ou átomos de hidrogênio e outro os recebe, alterando seus respectivos estados de oxidação.
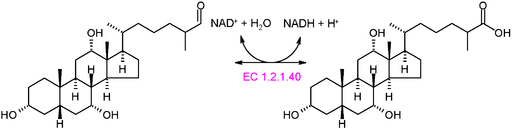 Esquema gráfico da reação de uma oxidortase do tipo EC 1.2.1.40 (Fonte: Akane700 [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)] via Wikimedia Commons)
Esquema gráfico da reação de uma oxidortase do tipo EC 1.2.1.40 (Fonte: Akane700 [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)] via Wikimedia Commons) Exemplo de enzimas oxidórticas muito comuns na natureza é o de desidrogenases e oxidases. Pode -se mencionar à enzima da álcool desidrogenase, que catalisa a desidrogenação do etanol para produzir acetaldeído em um NAD+ dependente ou na reação reversa, para produzir etanol durante a fermentação alcoólica realizada por alguns meias comercialmente importantes.
As enzimas da cadeia transportadora de elétrons nas células aeróbicas são oxidortas encarregadas do bombeamento de prótons; portanto, geram o gradiente eletroquímico através da membrana mitocondrial interna que permite aumentar a síntese de ATP.
[TOC]
Características gerais
As enzimas oxidoredutase são enzimas que catalisam a oxidação de um composto e a redução concomitante de outro.
Isso normalmente requer a presença de diferentes tipos de coenzimas para sua operação. Coenzimas cumprem a função de doar ou aceitar.
Essas coenzimas podem ser o Nad+/Nadh Torus ou o torque FAD/FADH2. Em muitos sistemas metabólicos aeróbicos, esses elétrons e átomos de hidrogênio são finalmente transferidos das coenzimas envolvidas para o oxigênio.
São enzimas com uma "falta" de especificidade do substrato, permitindo que eles catalisem reações cruzadas em diferentes tipos de polímeros, sejam proteínas ou carboidratos.
Classificação
Muitas vezes, a nomenclatura e a classificação dessas enzimas são baseadas no substrato principal que eles usam e no tipo de coenzima que eles precisam para funcionar.
De acordo com as recomendações do Comitê de Nomenclatura da União Internacional de Bioquímica e Biologia Molecular (NC-IBMB), essas enzimas pertencem à classe E.C. 1 e inclua mais ou menos 23 tipos diferentes (e.C.1.1-e.C.1.23), que são:
Pode servir a você: eritropoietina (EPO): características, produção, funções- E.C. 1.1: que atuam nos grupos de doadores CH-OH.
- E.C. 1.2: que atuam no grupo Aldeyde ou no grupo de doadores Oxo de Los.
- E.C. 1.3: que atuam nos grupos CH-CH de doadores.
- E.C. 1.4: que agem nos grupos de doadores CH-NH2.
- E.C. 1.5: que agem nos grupos de doadores CH-NH.
- E.C. 1.6: que agem em NADH ou NADPH.
- E.C. 1.7: que atuam em outros compostos de nitrogênio, como doadores.
- E.C. 1.8: que atuam nos grupos de doadores de enxofre.
- E.C. 1.9: que agem nos grupos Hemo de doadores.
- E.C. 1.10: que atuam em doadores como difenoles e outras substâncias relacionadas.
- E.C. 1.11: que agem sobre peróxido como aceitador.
- E.C. 1.12: que atuam sobre hidrogênio como doador.
- E.C. 1.13: que atuam em doadores simples com a incorporação de oxigênio molecular (oxigenases).
- E.C. 1.14: que atuam em doadores "emparelhados", com a incorporação ou redução de oxigênio molecular.
- E.C. 1.15: que agem sobre superóxidos como aceitadores.
- E.C. 1.16: que oxidam os íons metálicos.
- E.C. 1.17: que agem em grupos CH2.
- E.C. 1.18: que atuam em proteínas que contêm ferro e assumem como doadores.
- E.C. 1.19: que agem sobre flavodoxina reduzida como um doador.
- E.C. 1.20: que atuam em doadores como fósforo e arsênico.
- E.C. 1.21: que atuam na reação x-h + y-h = x-y.
- E.C. 1.22: que atuam no halogênio dos doadores.
- E.C. 1.23: que reduzem os grupos C-O-C como aceitadores.
- E.C. 1.97: Outras oxidoriases.
Cada uma dessas categorias também inclui subgrupos nos quais as enzimas são separadas de acordo com a preferência de substratos.
Pode atendê -lo: sucessão primária: características e exemplosPor exemplo, dentro do grupo de oxidoredutases que atuam nos grupos CH-OH de seus doadores, existem alguns que preferem NAD+ ou NADP+ como aceitadores, enquanto outros usam citocromos, oxigênio, enxofre, etc.
Estrutura
Como o grupo de oxidoredutases é extremamente diversificado, estabelecer uma característica estrutural definida é bastante complicada. Sua estrutura não apenas varia de enzima para enzima, mas também entre espécies ou grupo de seres vivos e até célula a célula em diferentes tecidos.
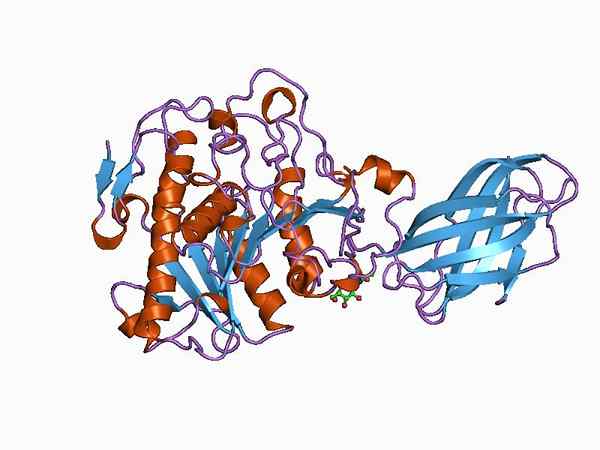
 Modelo de Bioinformática da Estrutura de uma enzima oxydutase (Fonte: Jawahar Swaminathan e funcionários do MSD no Instituto Europeu de Bioinformática [Domínio Público] via Wikimedia Commons)
Modelo de Bioinformática da Estrutura de uma enzima oxydutase (Fonte: Jawahar Swaminathan e funcionários do MSD no Instituto Europeu de Bioinformática [Domínio Público] via Wikimedia Commons) The enzyme pyruvate dehydrogenase, for example, is a complex composed of three sequentially linked catalytic subunits and known as the E1 subunit (dehydrogenase piruvate), the E2 subunit (dihydrolipamide acetyltransferase) and the E3 subunit (dihydrolipamide dehydrogenase).
Cada uma dessas subunidades, por sua vez, pode ser composta por mais de um monômero de proteína do mesmo tipo ou de tipos diferentes, ou seja, pode ser homodimérico (aqueles com apenas dois monômeros iguais), heterotrimérrica (que possui três monômeros diferentes) e assim por diante.
No entanto, geralmente são enzimas compostas por salões alfa e folhas banhadas β organizadas em diferentes formas, com interações intermoleculares específicas de diferentes tipos de tipos diferentes.
Funções
Enzimas oxidortadas catalisam reações de redução de óxido virtualmente em todas as células de todos os seres vivos na biosfera. Essas reações são geralmente reversíveis, na qual o estado de oxidação de um ou mais átomos dentro da mesma molécula é alterado.
Geralmente, os oxidorestos precisam de dois substratos, um que atua como doador de hidrogênio ou elétrons (que oxida) e outro que atua como aceitador de hidrogênio ou elétrons (que é reduzido).
Essas enzimas são extremamente importantes para muitos processos biológicos em diferentes tipos de células e organismos.
Eles trabalham, por exemplo, na síntese de melanina (um pigmento formado nas células da pele dos humanos), na formação e degradação da lignina (composto estrutural das células vegetais), na dobragem de proteínas, etc.
Pode atendê -lo: espécies introduzidas nas Ilhas GalápagosEles são usados industrialmente para modificar a textura de alguns alimentos e o exemplo destes são peroxidases, glicose oxidase e outros.
Além disso, as enzimas mais proeminentes desse grupo são aquelas que participam como transportadores eletrônicos nas cadeias transportadoras da membrana mitocondrial, cloroplastos e membrana plasmática interna de bactérias, onde são proteínas transmembranares.
Exemplos de oxidortas
Existem centenas de exemplos de enzimas oxidortadas na natureza e na indústria. Essas enzimas, como mencionadas, têm funções de extrema importância para o funcionamento celular e, portanto, para a vida por si só.
As oxididucases não apenas incluem enzimas peroxidase, laca, glicose oxidase ou álcool desidrogênico; Eles também combinam complexos importantes, como a enzima gliceraldeído, 3-fosfato desidrogenase ou a complexenus desidrogenase, etc., essencial do ponto de vista do catabolismo da glicose.
Ele também inclui todas as enzimas do complexo de transporte eletrônico na membrana mitocondrial interna ou na membrana interna de bactérias, semelhante a algumas das enzimas encontradas nos cloroplastos dos organismos vegetais.
Peroxidases
As peroxidases são enzimas muito diversas e usam peróxido de hidrogênio como aceitador de elétrons para catalisar a oxidação de uma variedade de substratos, incluindo fenóis, aminas ou tiíolos, entre outros. Em suas reações, eles reduzem o peróxido de hidrogênio até produzir água.
Eles são muito importantes do ponto de vista industrial, sendo a peroxidase do rabanete picante o mais importante e o mais estudado de todos.
Biologicamente falando, as peroxidases são importantes para a eliminação de compostos de oxigênio reagentes que podem causar danos significativos às células.
Referências
- Enciclopédia Britannica. (2019). Recuperado em 26 de dezembro de 2019, da www.Britannica.com
- Ercili-cura, d., Hupperz, t., & Kelly, um. eu. (2015). Modificação enzimática da textura do produto leiteiro. Na modificação da textura alimentar (pp. 71-97). Woodhead Publishing.
- Mathews, c. K., Van holde, k. E., & Ahern, k. G. (2000). Bioquímica. ADICIONAR. Wesley Longman, São Francisco.
- Nelson, d. eu., Lehninger, a. eu., & Cox, M. M. (2008). Lehninger Principles of Biochemistry. Macmillan.
- Comitê de Nomenclatura da União Internacional de Bioquímica e Biologia Molecular (NC-IBMB). (2019). Recuperado de www.Qmul.AC.UK/SBCS/iubmb/enzima/índice.Html
- Patel, m. S., Nemeria, n. S., Furey, w., & Jordan, F. (2014). Os complexos de piruvato desidrogenase: função e regulação da estrutura-base. Journal of Biological Chemistry, 289 (24), 16615-16623.

