Estrutura molecular de oxigênio, propriedades, usa
- 1556
- 247
- Shawn Leffler
Ele Oxigênio molecular qualquer Dioxigênio, Também chamado de oxigênio diatômico ou gasoso, é a forma elementar mais comum na qual esse elemento é encontrado no planeta Terra. Sua fórmula é ou2, Portanto, sendo uma molécula diatômica e homonuclear, totalmente apolar.
O ar que respiramos é composto de cerca de 21% de oxigênio como moléculas ou2. Quanto mais subimos, as concentrações de oxigênio a gás diminuem e aumentam a presença de ozônio, ou3. Nosso corpo tira vantagem do O2 Para oxigenar seus tecidos e realizar a respiração celular.
 Sem oxigênio enriquecer a vida de nossa atmosfera seria um fenômeno insustentável. Fonte: Pixabay.
Sem oxigênio enriquecer a vida de nossa atmosfera seria um fenômeno insustentável. Fonte: Pixabay. O o2 Ele também é responsável pela existência de fogo: sem ele, seria quase impossível ter incêndios e combustões. Isso ocorre porque sua propriedade principal é ser um poderoso agente oxidante, ganhar elétrons ou reduzir uma molécula de água, ou em ânions de óxido, ou2-.
O oxigênio molecular é essencial para inúmeros processos aeróbicos, com aplicações em metalurgia, medicina e tratamento de águas residuais. Este gás é praticamente sinônimo de calor, respiração, oxidação e, por outro lado, de temperaturas congeladas quando tem em seu estado líquido.
[TOC]
Estrutura molecular de oxigênio
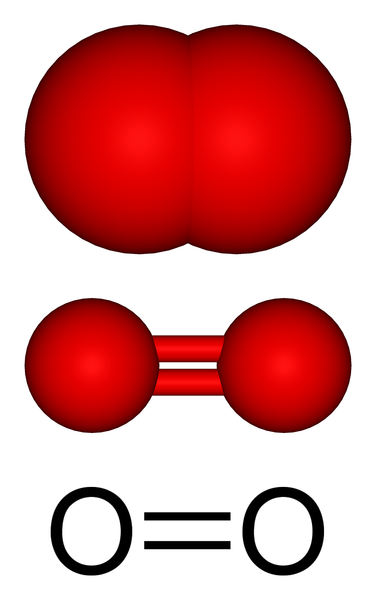
 Estrutura molecular de oxigênio gasoso. Fonte: Benjah-BMM27 via Wikipedia.
Estrutura molecular de oxigênio gasoso. Fonte: Benjah-BMM27 via Wikipedia. Na imagem superior, temos a estrutura molecular do oxigênio gasoso representado com vários modelos. Nos dois últimos, as características da ligação covalente que mantêm os átomos de oxigênio são evidenciados: uma ligação dupla o = o, na qual cada átomo de oxigênio completa seu octeto de Valência.
Pode atendê -lo: DIRETEOMERSA molécula ou2 É linear, homonuclear e simétrico. Sua ligação dupla tem um comprimento de 121 pm. Esta curta distância torna uma certa energia considerável necessária (498 kJ/mol) para quebrar o link o = O e, portanto, é uma molécula relativamente estável.
Nesse caso, o oxigênio da atmosfera teria se degradado completamente ao longo do tempo, ou o ar pegaria fogo em nada.
Propriedades
Aparência física
O oxigênio molecular é um gás incolor, sem gosto e inodoro, mas quando condensação e cristalização adquire tons azulados.
Massa molar
32 g/mol (valor arredondado)
Ponto de fusão
-218 ºC
Ponto de ebulição
-183
Solubilidade
O oxigênio molecular não é muito solúvel em água, mas o suficiente para apoiar a fauna marinha. Se sua solubilidade fosse maior, seria menos provável que morresse de afogamento. Por outro lado, sua solubilidade é muito maior em óleos e líquidos apolares, sendo capaz de oxidá -los lentamente e, assim, afetar suas propriedades originais.
Estados de energia
O oxigênio molecular é uma substância que não pode ser completamente descrita pela teoria do Link de Valencia (TEV).
A configuração eletrônica de oxigênio é a seguinte:
[Ele] 2s² 2p⁴
Tem um par de elétrons ausentes (ou :). Quando dois átomos de oxigênio são encontrados, eles estão ligados para formar uma ligação dupla o = o, completando o octeto de Valencia.
Portanto, a molécula ou2 Deve ser diamagnético, com todos os seus elétrons emparelhados. No entanto, é uma molécula paramagnética, e isso é explicado pelo diagrama de seus orbitais moleculares:
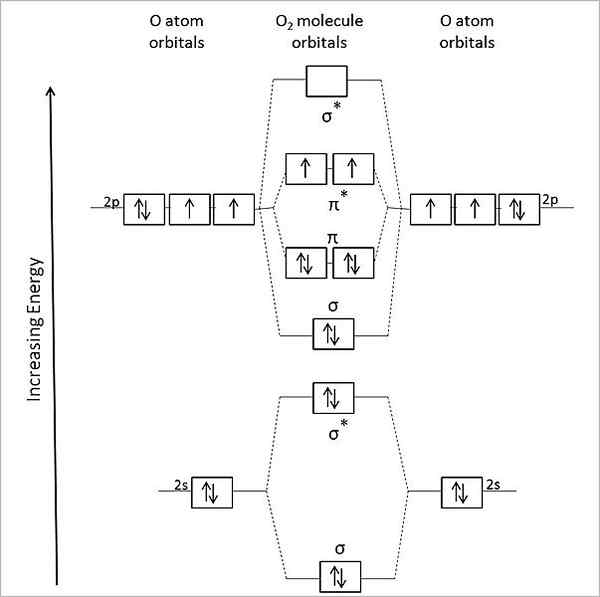 Diagrama orbital molecular para oxigênio a gás. Fonte: Anthony.Sebastian/CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/3.0)
Diagrama orbital molecular para oxigênio a gás. Fonte: Anthony.Sebastian/CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/3.0) Assim, a teoria orbital molecular (TOM) descreve melhor o ou2. Os dois elétrons ausentes estão localizados nos orbitais moleculares π*, de maior energia e dar oxigênio com seu caráter paramagnético.
Pode atendê -lo: metilamina: estrutura, propriedades, produção, usosDe fato, esse estado energético corresponde ao trigêmeo de oxigênio, 3QUALQUER2, O mais predominante de todos. O outro estado energético de oxigênio, menos abundante na Terra, é o único, 1QUALQUER2.
Transformações
O oxigênio molecular é consideravelmente estável, desde que não esteja em contato com nenhuma substância que seja suscetível a oxidação, muito menos se não houver uma fonte próxima de calor intenso, como uma faísca. Isso é porque o2 Tem uma alta tendência a reduzir, ganhar elétrons de outros átomos ou moléculas.
Quando reduzido, é capaz de estabelecer um amplo espectro de links e formas. Se formar ligações covalentes, fará isso com menos átomos eletronegativos do que ele, incluindo hidrogênio, para originar água, H-O-H. Também pode ser um universo de carbono, causar ligações C-O e vários tipos de moléculas orgânicas oxigenadas (Éteres, cetonas, aldeídos, etc.).
O o2 Você também pode ganhar elétrons para se transformar em peróxidos e superóxidos, ou22- EU2-, respectivamente. Quando se torna peróxido dentro do organismo, é obtido peróxido de hidrogênio, h2QUALQUER2, H-O-O-H, um composto prejudicial que é processado pela ação de enzimas específicas (peroxidases e catalas).
Por outro lado, e não menos importante, o O2 reage com a matéria inorgânica para se tornar ânion de óxido, ou2-, compondo uma lista interminável de massas mineralógicas que incham a casca e o manto da terra.
Formulários
Soldas e combustão
 O oxigênio é usado para combustão acetileno e disparar uma chama de calor intenso que é valioso nas soldas. Fonte: Sheila/CC por (https: // CreativeCommons.Org/licenças/por/2.0)
O oxigênio é usado para combustão acetileno e disparar uma chama de calor intenso que é valioso nas soldas. Fonte: Sheila/CC por (https: // CreativeCommons.Org/licenças/por/2.0) O oxigênio é usado para realizar a reação de combustão, pela qual uma substância é exotermicamente emitindo fogo. Este fogo e sua temperatura variam dependendo da substância que está queimando. Assim, chamas muito quentes podem ser obtidas, como acetileno (acima), com os quais metais e ligas são soldados.
Pode servir você: entalpiaSe não fosse por oxigênio, os combustíveis não poderiam queimar e fornecer toda a sua energia calórica, usados para tirar foguetes ou para iniciar carros.
Agente oxidante em química verde
Graças a este gás, um interminável óxido orgânico e inorgânico é sintetizado ou produzido industrialmente. Essas reações são baseadas no poder oxidante do oxigênio molecular, sendo também um dos reagentes mais viáveis da química verde para obter produtos farmacêuticos.
Respiração assistida e tratamento de águas residuais
O oxigênio é vital para atender à demanda respiratória em pacientes com estados de saúde graves, em mergulhadores quando descem em profundidades baixas e em alpinistas de montanhas, em cujas altitudes a concentração de oxigênio parece dramaticamente reduzida.
Da mesma forma, o oxigênio "alimenta" bactérias aeróbicas, que ajudam.
Referências
- Shiver & Atkins. (2008). Química Inorgânica. (quarta edição). Mc Graw Hill.
- Wikipedia. (2020). Alotropes de oxigênio. Recuperado de: em.Wikipedia.org
- Hone, c.PARA., Kappe, c.QUALQUER. (2019). O uso de oxigênio molecular para oxidações aeróbicas de fase líquida no fluxo contínuo. Top Curr Chem (Z)377, 2. doi.org/10.1007/S41061-018-0226-Z
- Kevin Beck. (28 de janeiro de 2020). 10 usos para oxigênio. Recuperado de: cienting.com
- CliffsNotes. (2020). Bioquímica I: A Química do Oxigênio Molecular. Recuperado de: penhascos.com
- GZ Suprimentos Industriais. (2020). Benefícios industriais do gás oxigênio. Recuperado de: GZ-Supplies.com
- « Cultura de tradições, costumes, gastronomia, religião
- Fórmula de interferência destrutiva e equações, exemplos, exercícios »

