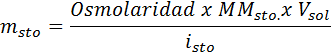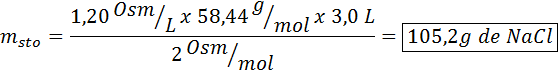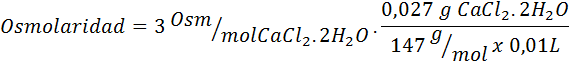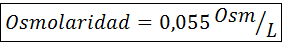Osmolaridade
- 4419
- 1362
- Conrad Schmidt
O que é osmolaridade?
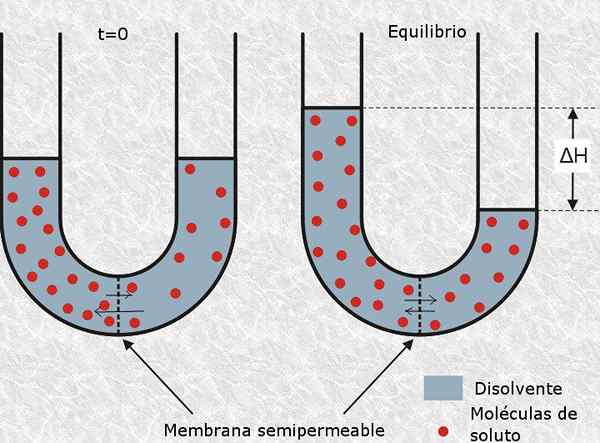
O Osmolaridade É uma unidade de concentração que indica a concentração molar do conjunto de partículas osmoticamente ativas presentes em uma solução. Em outras palavras, a osmolaridade é a molaridade de partículas osmoticamente ativas.
é definido como partícula osmoticamente ativa para essa molécula neutra ou de íons que não pode atravessar uma membrana semipermeável, como a membrana celular. A presença desse tipo de partículas gera pressão osmótica na solução e, portanto, seu nome.
O número de moles de partículas osmoticamente ativas é chamado Osmoles (representado pelo símbolo OSM), de modo que a osmolaridade é expressa em unidades de OSM/L.
A importância da osmolaridade
Osmolaridade são um conceito de grande importância para a biologia e a medicina, uma vez que o equilíbrio osmótico de células com seu ambiente é essencial para sua sobrevivência. Por exemplo, injetar uma solução com uma osmolaridade muito alta ou muito baixa por via intravenosa, pode facilmente causar a morte a um paciente.
 Osmolaridade são um aspecto essencial das soluções em medicina e biologia
Osmolaridade são um aspecto essencial das soluções em medicina e biologia Por outro lado, uma técnica muito comum que os biólogos celulares usam para quebrar células de diferentes tipos é através da lise osmótica. Isso consiste em colocar as células em uma solução hipotônica (com uma osmolaridade muito baixa), de modo que a água da solução as penetra por osmose e as explode.
Isso o torna muito importante, tanto para médicos quanto para biólogos e profissionais de outras áreas, sabendo, medindo ou sabendo como calcular a osmolaridade de uma solução.
Pode atendê -lo: concentração percentualDiferenças entre osmolaridade e osmolalidade
Ao falar sobre osmolaridade, também é necessário falar sobre osmolalidade. Osmolalidade são semelhantes à osmolaridade, da mesma maneira que a moralidade é semelhante à molaridade.
Enquanto osmolaridade indica o Número de osmoles por litro de solução (OSM/L), Osmolalidade indica o mesmo, mas Para cada quilograma de solvente (OSM/kg).
Osmolalidade têm a vantagem de que, não dependendo do volume da solução, nem depende da densidade ou temperatura. Por esse motivo, uma solução terá a mesma osmolalidade a 25 ° C como a 37 ° C. Por outro lado, sua osmolaridade de 37 ° C será ligeiramente menor que sua osmolaridade a 25 ° C, devido ao aumento do volume de expansão térmica.
A osmolaralidade é geralmente mais fácil de medir experimentalmente do que a osmolaridade. No entanto, a osmolaridade é mais fácil de calcular e é uma unidade mais fácil de trabalhar quando as diluições são preparadas.
Como a osmolaridade de uma solução é calculada?
Existem várias maneiras de calcular a osmolaridade de uma solução, dependendo das informações que são contadas. Pode ser calculado a partir de:
- As quantidades de soluto e solução.
- A molaridade dos solutos presentes.
- Concentrações de íons individuais.
- A porcentagem m/v dos solutos, entre outros.
Em todos os casos, o cálculo é baseado na fórmula geral de osmolaridade, que é:

Onde nOSM É o número de osmoles presentes na solução e Vsol É o volume do mesmo expresso em litros. O número de osmoles é calculado multiplicando o número de moles no soluto pelo número de partículas em que se dissocia em solução.
Pode atendê -lo: misturas heterogêneas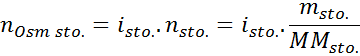
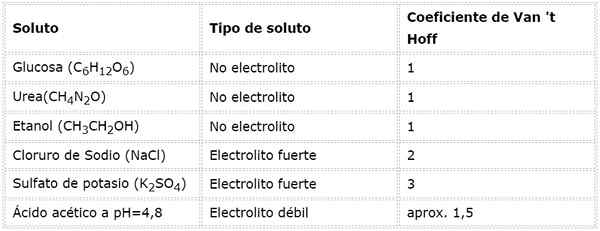
Nesta equação, nSto É o número de moles de soluto, mSto é sua massa (em g), MilímetrosSto É sua massa molar (em g/mol) e YoSto É o coeficiente de van 't hoff do soluto. Este coeficiente tem um valor de 1 para solutos não -eletrólitos (Como glicose, por exemplo).
Para eletrólitos fortes que são completamente dissociados (como cloreto de sódio, NaCl), o coeficiente de van 't hoff é igual ao número total de íons em que cada mole do composto se dissocia.
Por exemplo, no caso de sulfato de potássio, k2SW4, cuja reação de dissociação é:
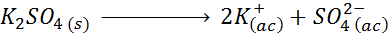
Cada mol do sal que se dissolve produz 3 moles de íons (2 K íons+ E 1 SO ION42-), pelo que I = n = 3.
No caso de eletrólitos fracos, o cálculo é mais complicado, mas geralmente são determinados experimentalmente. A tabela a seguir resume os coeficientes de Van 'T Hoff para alguns solutos comuns.
Exemplos de cálculo de osmolaridade
1. Exemplo 1
Determine a osmolaridade de uma solução preparada dissolvendo 10 g de NaCl e 10 g de glicose em 100 ml de solução
Solução: Nesse caso, os osmoles de cada soluto são calculados separadamente e adicione. As massas molares são de 58,45 g/mol e 180 g/mol, respectivamente, e os coeficientes de ve 't hoff são 2 e 1:
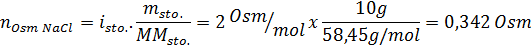
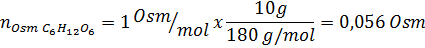
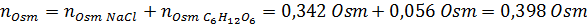
Agora calculamos a osmolaridade usando a fórmula, sabendo que 100 ml é igual a 0,100L:
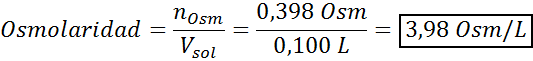
Finalmente, a osmolaridade da solução é 3,98 OSM/L.
2. Exemplo 2
Determine a osmolaridade de uma solução 0,05 Sulfato de potássio molar.
Solução: Se já conhecemos a molaridade do soluto, calcular a osmolaridade é tão simples quanto multiplicar essa concentração pelo fator de van 't hoff.
Pode servir você: benzaldeído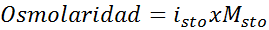
Nesse caso, o fator de sal é 3.
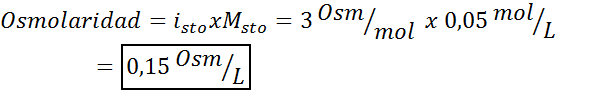
3. Exemplo 3
Determine a osmolaridade de uma amostra de plasma contendo íons de sódio 0,125 M, íons de potássio 0,020 m e 0,145 íons de cloreto.
Solução: A osmolaridade dos íons individuais é igual à sua molaridade, uma vez que os íons não se dissociam mais e têm um I = 1. Por esse motivo, neste caso, é necessário apenas se multiplicar por I = 1 Cada concentração e adicione:
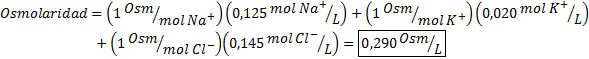
4. Exemplo 4
Calcule a osmolaridade de uma solução contendo 27 mg de limite2.2h2Ou para cada 10 ml de solução
Solução: O peso molecular de Cochl2.2h2Ou é 147 g/mol. Ao se dissolver, esse sal é separado em 2 moléculas de água e três íons. No entanto, as moléculas de água não são partículas osmoticamente ativas, portanto não são levadas em consideração para o cálculo da osmolaridade, e o coeficiente para este composto é 3.

5. Exemplo 5
Que massa de cloreto de sódio é necessária para preparar 3 litros de uma solução cuja osmolaridade é 1,20 OSM/L?
Solução: Nesse caso, à medida que a massa de soluto é solicitada e temos o volume e a concentração, é suficiente para limpar a massa da fórmula osmolaridade.