Notação espectral

- 1691
- 275
- Tim Mann
 Tabela que indica os níveis e os orbitais
Tabela que indica os níveis e os orbitais O que é notação espectral?
O Notação espectral É o arranjo de elétrons nos níveis de energia ao redor do núcleo de um átomo. De acordo com o antigo modelo atômico de Bohr, os elétrons ocupam vários níveis em órbitas ao redor do núcleo, da primeira camada mais próxima do núcleo, K, até a sétima camada, Q, que é o mais distante do núcleo.
Em termos de um modelo mecânico quântico mais refinado, as camadas K-Q são subdivididas em um conjunto de orbitais, cada um dos quais pode ser ocupado por não mais que alguns elétrons.
Geralmente, a configuração eletrônica é usada para descrever os orbitais de um átomo em seu estado fundamental, mas também pode ser usado para representar um átomo que foi ionizado em um cátion ou ânion, compensando a perda ou ganho de elétrons em seus respectivos orbitais.
Muitas das propriedades físicas e químicas dos elementos podem ser correlacionadas com suas configurações eletrônicas únicas. Os elétrons de Valência, elétrons na camada mais externa, são o fator determinante para a química única do elemento.
Quando os elétrons da camada mais externa de um átomo recebem energia de algum tipo, eles se movem para maiores camadas de energia. Assim, um elétron na camada k será transferido para a camada L estar em um estado de maior energia.
Quando o elétron retorna ao seu estado fundamental, libera a energia absorvida ao emitir um espectro eletromagnético (luz). Como cada átomo tem uma configuração eletrônica específica, ele também terá um espectro específico que será chamado de espectro de absorção (ou emissão).
Por esse motivo, a notação espectral do termo é usada para se referir à configuração eletrônica.
Como determinar a notação espectral: números quânticos
Um total de quatro números quânticos são usados para descrever completamente o movimento e as trajetórias de cada elétron dentro de um átomo.
A combinação de todos os números quânticos de todos os elétrons em um átomo é descrito por uma função de onda que atende à equação de Schrödinger. Cada elétron em um átomo tem um conjunto único de números quânticos.
Pode servir a você: fração molar: como é calculado, exemplos, exercíciosDe acordo com o princípio de exclusão de Pauli, dois elétrons não podem compartilhar a mesma combinação de quatro números quânticos.
Os números quânticos são importantes porque podem ser usados para determinar a configuração eletrônica de um átomo e a provável localização dos elétrons de átomos.
Os números quânticos também são usados para determinar outras características dos átomos, como energia de ionização e raio atômico.
Os números quânticos designam conchas, subcaps, orbitais e elétrons específicos.
Isso significa que eles descrevem completamente as características de um elétron em um átomo, ou seja, descrevem cada solução única para a equação de Schrödinger, ou a função de onda, elétrons em um átomo.
Há um total de quatro números quânticos: o número quântico principal (n), o número quântico do angular orbital (l), o número quântico magnético (ml) e o número quântico do giro de elétrons (ms).
O número quântico principal, nn, descreve a energia de um elétron e a distância mais provável do elétron do núcleo. Em outras palavras, refere -se ao tamanho do orbital e ao nível de energia em que um elétron é colocado.
O número de subcaps, ou LL, descreve a forma do orbital. Também pode ser usado para determinar o número de nós angulares.
O número quântico magnético, ML, descreve os níveis de energia em um subcap e mais se refere ao giro no elétron, que pode ser para cima ou para baixo.
Princípio da Aufbau
Aufbau vem da palavra alemã Aufbauen, O que significa "construir". Em essência, ao escrever configurações de elétrons, estamos construindo orbitais de elétrons à medida que avançamos de um átomo para outro.
Enquanto escrevemos a configuração eletrônica de um átomo, preencheremos os orbitais em uma ordem crescente de número atômico.
O princípio da Aufbau se origina do princípio de exclusão de Pauli, que diz que não há dois férmions (por exemplo, elétrons) em um átomo.
Pode atendê -lo: ácido butírico: fórmula, propriedades, riscos e usosEles podem ter o mesmo conjunto de números quânticos, então precisam "acumular" em níveis mais altos de energia. Como os elétrons se acumulam é um tópico de configurações de elétrons.
Os átomos estáveis têm tantos elétrons quanto os prótons no núcleo. Os elétrons se reúnem ao redor do núcleo em orbitais quânticos seguindo quatro regras básicas chamadas princípios de Aufbau.
1. Não há dois elétrons no átomo que compartilhassem os mesmos quatro números quânticos N, L, M e S.
2. Os elétrons ocuparão primeiro os orbitais do menor nível de energia.
3. Os elétrons vão preencher os orbitais sempre com o mesmo número de rotação. Quando os orbitais estiverem cheios, ele começará.
4. Os elétrons preencherão orbitais para a soma dos números quânticos N e L. Os orbitais com valores iguais (n + l) serão preenchidos primeiro com valores mais baixos de n.
A segunda e a quarta regras são basicamente as mesmas. Um exemplo da Regra Quatro seria os orbitais 2p e 3s.
Um orbital 2p é n = 2 e l = 2 e um orbital 3s é n = 3 e l = 1. (N + l) = 4 em ambos os casos, mas o orbital 2p tem a menor energia ou menor valor e será preenchido antes da camada 3s.
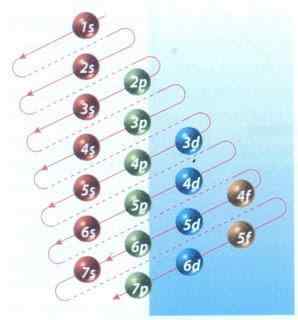 Figura 2: Diagrama de Moeller do enchimento de configuração eletrônica
Figura 2: Diagrama de Moeller do enchimento de configuração eletrônica Felizmente, você pode usar o diagrama Moeller mostrado na Figura 2 para preencher os elétrons. O gráfico é lido executando as diagonais de 1s.
A Figura 2 mostra os orbitais atômicos e as setas indicam a maneira de seguir.
Agora que se sabe que a ordem dos orbitais está preenchida, a única coisa que resta é memorizar o tamanho de cada orbital.
Os orbitais têm 1 valor possível de meu Para conter 2 elétrons
P orbitais têm 3 valores possíveis de meu Para conter 6 elétrons
Os orbitais têm 5 valores possíveis de Meu Para conter 10 elétrons
Os orbitais têm 7 valores possíveiseu Para conter 14 elétrons
Isso é tudo o que é necessário para determinar a configuração eletrônica de um átomo estável de um elemento.
Pode servir a você: Dodecil Sodium Sulfato (SDS): estrutura, propriedades, usosPor exemplo, pegue o elemento de nitrogênio. O nitrogênio tem sete prótons e, portanto, sete elétrons. O primeiro orbital a preencher é o Orbital 1s. Um orbital S tem dois elétrons, então restam cinco elétrons.
O próximo orbital é o 2S orbital e contém os próximos dois. Os três elétrons finais irão para o orbital 2p que pode conter até seis elétrons.
Regras de afundamento
A seção Aufbau discutiu como os elétrons preenchem os orbitais mais baixos de energia primeiro e depois se movem para os orbitais de energia mais altos somente após os orbitais de energia mais baixa estiverem cheios.
No entanto, há um problema com esta regra. Certamente, 1s orbitais devem ser preenchidos antes de 2s orbitais, porque 1s orbitais têm um valor mais baixo de n e, portanto, uma energia mais baixa.
E os três orbitais diferentes? Em que ordem eles devem ser preenchidos? A resposta a esta pergunta envolve regra de pia.
A regra da pia estabelece que:
- Cada orbital em um sub -nível é ocupado individualmente antes que qualquer orbital seja duplamente ocupado.
- Todos os elétrons em orbitais ocupados individualmente têm o mesmo turno (para maximizar o turno total).
Quando os elétrons são atribuídos a orbitais, um elétron procura primeiro preencher todos os orbitais com energia semelhante (também chamada de degeneração orbitais) antes de combinar com outro elétron em meio -Orbital Fulll.
Átomos nos estados terrestres tendem a ter o maior número possível de elétrons. Ao visualizar esse processo, considere como os elétrons exibem o mesmo comportamento que os mesmos pólos em um ímã se eles entrarem em contato.
Quando os elétrons carregados negativamente preenchem os orbitais, eles primeiro tentam fugir o máximo possível antes de ter que combinar.
Referências
- Números quânticos. Química recuperada.Librettexts.org.
- Configurações de elétrons e propriedades dos átomos (S.F.). Recuperado de Oneonta.Edu.
- Configuração eletronica. Recuperado da Britannica.com.

